题目内容
实验室中要测定部分变质的过氧化钠的纯度,可用下图装置实验.
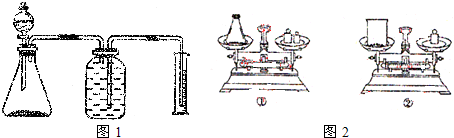
(1)锥形瓶中应放药品 ,分液漏斗中放 ,锥形瓶中发生的化学方程式为 .
(2)如图用托盘天平称取样品,应选用如图中的 (填“①”或“②”).不选用另一装置的原因是 .
(3)若取用样品的质量为2.5g,收集到气体的体积为280mL(标准状况),则样品中Na2O2的纯度为 .

(1)锥形瓶中应放药品
(2)如图用托盘天平称取样品,应选用如图中的
(3)若取用样品的质量为2.5g,收集到气体的体积为280mL(标准状况),则样品中Na2O2的纯度为
考点:探究物质的组成或测量物质的含量,钠的重要化合物
专题:几种重要的金属及其化合物
分析:(1)Na2O2和空气中二氧化碳反应生成Na2CO3,Na2CO3易溶于水但和水不反应,Na2O2和水反应生成NaOH和氧气,所以锥形瓶中应盛Na2O2,分液漏斗中装水;
(2)用托盘天平称量药品时应该遵循“左物右砝”原则,过氧化钠易和空气中水、二氧化碳反应,应该密封称量;
(3)只有Na2O2和水反应生成O2,根据氧气和Na2O2之间的关系式计算Na2O2质量,从而计算其纯度.
(2)用托盘天平称量药品时应该遵循“左物右砝”原则,过氧化钠易和空气中水、二氧化碳反应,应该密封称量;
(3)只有Na2O2和水反应生成O2,根据氧气和Na2O2之间的关系式计算Na2O2质量,从而计算其纯度.
解答:
解:(1)Na2O2和空气中二氧化碳反应生成Na2CO3,Na2CO3易溶于水但和水不反应,Na2O2和水反应生成NaOH和氧气,所以锥形瓶中应盛Na2O2,分液漏斗中装水,反应方程式为Na2O2+2H2O=4NaOH+O2↑,故答案为:Na2O2;水;Na2O2+2H2O=4NaOH+O2↑;
(2)用托盘天平称量药品时应该遵循“左物右砝”原则,过氧化钠易和空气中水、二氧化碳反应,应该密封称量,所以选①,故答案为:①;由于Na2O2易吸收空气中的CO2和H2O,所以不能暴露在空气中称量;
(3)产生O2的物质的量为
=0.0125 mol
设过氧化钠的质量为m,
2 Na2O2+2H2O=4NaOH+O2↑
2×78g 1 mol
m 0.0125mol
156g:1mol=m:0.0125mol,
m=
=1.95g
样品中Na2O2的纯度为
×100%=78%.
故答案为:78%.
(2)用托盘天平称量药品时应该遵循“左物右砝”原则,过氧化钠易和空气中水、二氧化碳反应,应该密封称量,所以选①,故答案为:①;由于Na2O2易吸收空气中的CO2和H2O,所以不能暴露在空气中称量;
(3)产生O2的物质的量为
| 280×10-3L |
| 22.4L?mol-1 |
设过氧化钠的质量为m,
2 Na2O2+2H2O=4NaOH+O2↑
2×78g 1 mol
m 0.0125mol
156g:1mol=m:0.0125mol,
m=
| 0.0125mol×156g |
| 1mol |
样品中Na2O2的纯度为
| 1.95g |
| 2.5g |
故答案为:78%.
点评:本题以过氧化钠为载体考查物质含量的测定,明确实验原理是解本题关键,知道反应装置仪器选取方法,侧重考查实验操作、实验设计及计算能力,题目难度不大.

练习册系列答案
相关题目
已知,mg Al在足量氯气中燃烧,生成固体的质量为(m+21.3)g,若将mgAl投入总质量为95.2g的NaOH水溶液中恰好完全反应,则所得溶液中溶质的质量分数为( )
| A、5.4% | B、8.0% |
| C、16.3% | D、16.4% |
NaCl晶体中钠和氯离子周围都是由六个相反离子按八面体形状排列的,解释这样的结构可以用( )
| A、杂化轨道 | B、键的极性 |
| C、离子大小 | D、离子电荷 |