题目内容
在一密闭绝热容器中,发生放热反应:SO2(g)+NO2(g)?SO3(g)+NO(g),下列有关说法正确的是( )
| A、反应达到平衡时,降低温度,平衡逆向移动 |
| B、使用催化剂,正反应速率增大,逆反应速率减小 |
| C、若反应体系温度不再变化,说明反应达到平衡状态 |
| D、减小SO2的浓度,平衡正向移动 |
考点:化学平衡的影响因素,化学反应速率的影响因素
专题:
分析:A、降温平衡向放热方向移动;
B、催化剂同等程度地增大正逆反应速率;
C、密闭绝热容器中,温度不变说明反应达到平衡状态;
D、减小反应物浓度平衡逆向移动.
B、催化剂同等程度地增大正逆反应速率;
C、密闭绝热容器中,温度不变说明反应达到平衡状态;
D、减小反应物浓度平衡逆向移动.
解答:
解:A、降温平衡正向移动,故A错误;
B、催化剂使正逆反应速率都增大,故B错误;
C、密闭绝热容器中,温度不变说明正逆反应速率相等,反应达到平衡状态,故C正确;
D、减小反应物二氧化硫的浓度平衡逆向移动,故D错误;
故选C.
B、催化剂使正逆反应速率都增大,故B错误;
C、密闭绝热容器中,温度不变说明正逆反应速率相等,反应达到平衡状态,故C正确;
D、减小反应物二氧化硫的浓度平衡逆向移动,故D错误;
故选C.
点评:本题考查影响化学反应速率的因素,为高频考点,把握温度对反应速率的影响为解答的关键,注意升高温度反应速率加快,无需关注放热反应,题目难度不大.

练习册系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ | ||||
B、电解饱和食盐水 2Cl-+2H+
| ||||
| C、在稀氨水中通入过量CO2 NH3?H2O+CO2=NH4++HCO3- | ||||
| D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2═Fe3++2H2O |
NaCl晶体中钠和氯离子周围都是由六个相反离子按八面体形状排列的,解释这样的结构可以用( )
| A、杂化轨道 | B、键的极性 |
| C、离子大小 | D、离子电荷 |

 某烧碱溶液中含有少量杂质(不与盐酸反应),现用标准盐酸滴定NaOH溶液,测定其浓度.
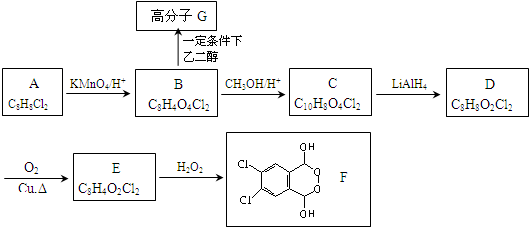
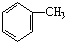
某烧碱溶液中含有少量杂质(不与盐酸反应),现用标准盐酸滴定NaOH溶液,测定其浓度.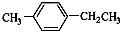 )是一种重要的有机原料,用该物质可合成其他物质.
)是一种重要的有机原料,用该物质可合成其他物质.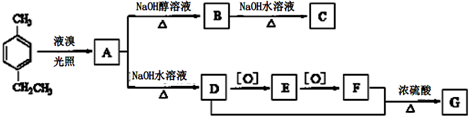
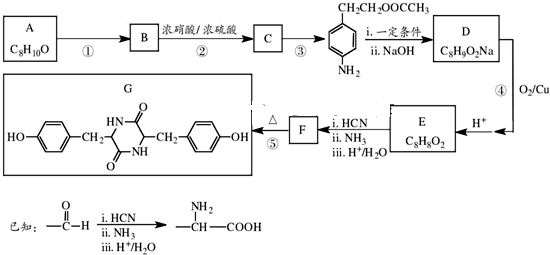
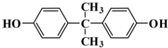 )与光气(
)与光气(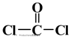 )聚合得到,请写出该聚碳酸酯的结构简式
)聚合得到,请写出该聚碳酸酯的结构简式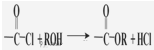 )
)