题目内容
1.将SO2通入BaCl2溶液至饱和,未见白色沉淀出现,继续通入另一种气体,观察到有白色沉淀出现,则通入的气体不可能是( )| A. | NH3 | B. | HCl | C. | Cl2 | D. | NO2 |
分析 SO2气体通入BaCl2溶液中,未见白色沉淀,不发生反应,继续通入另一种气体立即产生沉淀,沉淀可能为硫酸钡或亚硫酸钡,也可能为S,则气体具有氧化性或碱性等,以此来解答.
解答 解:A.氨气与二氧化硫反应生成亚硫酸根离子,与钡离子结合生成亚硫酸钡沉淀,故A不选;
B.HCl、二氧化硫与氯化钡溶液都不反应,不会产生沉淀,故B选;
C.氯气与二氧化硫发生氧化还原反应生成硫酸根离子,与钡离子结合生成硫酸钡沉淀,故C不选;
D.NO2 通入水生成硝酸,硝酸能够氧化二氧化硫生成硫酸根离子,与钡离子生成硫酸钡沉淀,故能产生沉淀,故D不选.
故选B.
点评 本题考查物质的性质,综合考查元素化合物知识,为高频考点,把握物质的性质、发生的氧化还原反应为解答的关键,注意二氧化硫的还原性、氧化性及酸性氧化物的性质,题目难度不大.

练习册系列答案
相关题目
11.常温下将盛有10mL NO2和10mL NO的混合气体的试管倒立于水槽中,并向其中通入O2一段时间后,试管内还剩余2mL气体,则通入O2的体积为( )
| A. | 8mL | B. | 8.5mL | C. | l0mL | D. | 13mL |
9.某元素的一种同位素X的原子质量数为A,含N个中子,X的最高价氧化物为XO3,则在a g X的气态氢化物中所含质子的物质的量是( )
| A. | $\frac{a}{A+3}$(A-N+3)mol | B. | $\frac{a}{A}$(A-N)mol | C. | $\frac{a}{A+2}$(A-N+2)mol | D. | $\frac{a}{A+3}$(A-N)mol |
16.下列有关元素周期表的描述中不正确的是( )
| A. | 第七周期叫不完全周期 | B. | 族有两类:主族和副族 | ||
| C. | 有18个列16个族 | D. | 金属元素位于表的左下部 |
6.下列能源中属于二次能源的是( )
| A. | 流水 | B. | 风力 | C. | 原煤 | D. | 电力 |
13.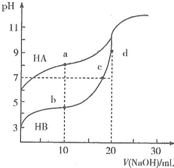 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | HA的酸性强于HB | B. | d点溶液中:c(Na+)>c(OH-)>c(B-)>c(H+) | ||
| C. | a和b点溶液中:c(B-)<c(A-) | D. | b点溶液中:c(B-)+2c(OH)-=c(HB)+2c(H+) |
10.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
请回答:
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是等于.
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是等于.
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).