题目内容
13.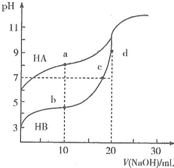 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | HA的酸性强于HB | B. | d点溶液中:c(Na+)>c(OH-)>c(B-)>c(H+) | ||
| C. | a和b点溶液中:c(B-)<c(A-) | D. | b点溶液中:c(B-)+2c(OH)-=c(HB)+2c(H+) |
分析 A.浓度均为0.10mo1•L-1的HA溶液和HB溶液,溶液的pH越小,酸的酸性越强;
B.D点的溶液中溶质为NaB,B-水解溶液显碱性;
C.根据点①和点②所示溶液中的电荷守恒c(OH-)+c(A-)=c(Na+)+c(H+)、c(OH-)+c(B-)=c(Na+)+c(H+)分析;
D.b点溶液中溶质为等浓度的HB和NaB,根据物料守恒和电荷守恒分析.
解答 解:A.浓度均为0.10mo1•L-1的HA溶液和HB溶液,溶液的pH越小,酸的酸性越强,滴定前HB的pH小,所以酸性HB的强,故A错误;
B.D点的溶液中溶质为NaB,B-水解溶液显碱性,由于水解程度一般较小,所以c(B-)>c(OH-),则溶液中:c(Na+)>c(OH-)>c(B-)>c(H+),故B错误;
C.点①的溶液中存在电荷守恒为c(OH-)+c(A-)=c(Na+)+c(H+),而且c(OH-)>c(H+),点②所示溶液中的电荷守恒为c(OH-)+c(B-)=c(Na+)+c(H+),而且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(B-)>c(A-),故C错误;
D.b点溶液中溶质为等浓度的HB和NaB,溶液中电荷守恒为c(OH-)+c(B-)=c(Na+)+c(H+),物料守恒为2c(Na+)=c(B-)+c(HB),所以b点溶液中:c(B-)+2c(OH)-=c(HB)+2c(H+),故D正确.
故选D.
点评 本题考查酸碱混合溶液中离子浓度的关系,明确混合后溶液中的溶质是解答的关键,注意电荷守恒和物料守恒的应用,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
3.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图.根据实验,以下说法正确的是( )
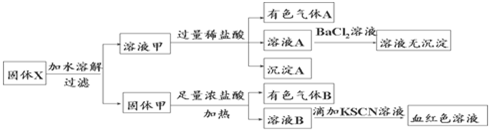

| A. | 溶液甲中一定含有K2SiO3、NaNO2、可能含有KAlO2、K2CO3 一定不含有K2SO3 | |
| B. | 沉淀A为H2SiO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中一定含有Fe2O3 |
4.下列叙述正确的是( )
| A. | 丙烷分子中3个碳原子一定在同一条直线上 | |
| B. | 丙烯分子中3个碳原子都在同一平面 | |
| C. | 乙烷分子中碳原子和全部氢原子可能在同一平面上 | |
| D. | 2-丁烯分子中4个碳原子在同一平面上 |
1.将SO2通入BaCl2溶液至饱和,未见白色沉淀出现,继续通入另一种气体,观察到有白色沉淀出现,则通入的气体不可能是( )
| A. | NH3 | B. | HCl | C. | Cl2 | D. | NO2 |
8.F、CI和Br都是第七主族元素,关于这三种元素原子的说法正确的是( )
| A. | 原子半径:F>CI>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数都不相同 |
18.下列各组物质性质的排列顺序不正确的是( )
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 稳定性:HF>H2O>H2S | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 熔沸点:Rb>K>Na>Li |
2.自来水常用氯气消毒,某实验室用自来水配制下列物质的溶液,不会产生明显药品变质问题的是( )
| A. | FeCl2 | B. | Na2SO4 | C. | NaOH | D. | AlCl3 |

 (R,R′,R″代表相同或不相同的烃基)
(R,R′,R″代表相同或不相同的烃基) .
. .
. .
.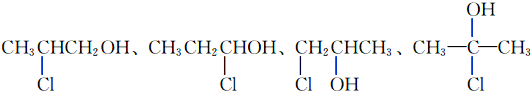 .
. CuSO4•5H2O是铜的重要化合物,有着广泛的应用.硫酸铜在高温下分解可得到SO2、SO3、O2和Cu2O.
CuSO4•5H2O是铜的重要化合物,有着广泛的应用.硫酸铜在高温下分解可得到SO2、SO3、O2和Cu2O.