题目内容
11.常温下将盛有10mL NO2和10mL NO的混合气体的试管倒立于水槽中,并向其中通入O2一段时间后,试管内还剩余2mL气体,则通入O2的体积为( )| A. | 8mL | B. | 8.5mL | C. | l0mL | D. | 13mL |
分析 剩余的气体可能为氧气,有可能为NO,①当剩余的气体为氧气时,二氧化氮和NO完全反应,可以根据方程式4NO2+O2+2H2O═4HNO3、4NO+3O2+2H2O═4HNO3计算出通入氧气的总体积;
②当剩余的气体为NO时,可以看作二氧化氮完全反应,NO反应消耗了8mL,还剩余2mL,然后根据反应方程式计算出消耗的氧气的体积.
解答 解:①当剩下的气体为O2时,10mLNO2和10mL NO说明完全反应生成硝酸,则:
4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,
4 1 4 3
10mL 2.5mL 10mL 7.5mL
所以通入的氧气体积为:2.5mL+7.5mL+2mL=12mL;
②当剩余的气体为NO时,可以认为10mL NO2完全反应生成硝酸,10mLNO中剩余2mL,有8mL转化成硝酸,则:
4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,
4 1 4 3
10mL 2.5mL 8mL 6mL
所以通入氧气的体积为:2.5mL+6mL=8.5mL,
故选B.
点评 本题考查了有关混合物反应的化学计算,题目难度中等,明确反应后剩余气体组成为解答关键,注意掌握NO、二氧化氮与氧气、水转化成硝酸的反应原理,要求学生掌握讨论法在化学计算中的应用.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
1.下列说法错误的是( )
| A. | 煤可以直接液化,使煤与氢气作用生成液体燃料 | |
| B. | 利用风能、生物能发电,将火力发电用煤进行脱硫处理,有利于环保 | |
| C. | 氮化硅陶瓷、通讯光缆等都是新型无机非金属材料 | |
| D. | 塑料、橡胶、纤维这三大材料都是以石油、煤、天然气为原料生产的 |
2.根据如图所示情况,判断下列说法中正确的是( )
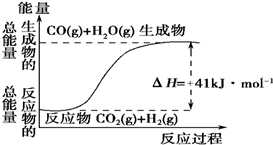

| A. | 其热化学方程式为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=41kJ•mol-1 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 若当H2O为液态时反应热为△H2,则△H2>△H |
19.下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl受热“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl受热“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
| A. | ①②④⑥⑦ | B. | ④⑥ | C. | ①④⑤⑧ | D. | ④⑥⑦⑧ |
16.某元素X,它的原子次外层电子数是最外层电子数的一半,则X在周期表中位于( )
| A. | 第二周期ⅣA族 | B. | 第三周期ⅣA族 | C. | 第四周期ⅣA族 | D. | 第二周期ⅥA族 |
3.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图.根据实验,以下说法正确的是( )
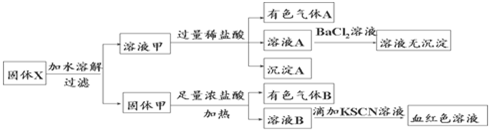

| A. | 溶液甲中一定含有K2SiO3、NaNO2、可能含有KAlO2、K2CO3 一定不含有K2SO3 | |
| B. | 沉淀A为H2SiO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中一定含有Fe2O3 |
1.将SO2通入BaCl2溶液至饱和,未见白色沉淀出现,继续通入另一种气体,观察到有白色沉淀出现,则通入的气体不可能是( )
| A. | NH3 | B. | HCl | C. | Cl2 | D. | NO2 |