题目内容
9.下列有关性质的比较,不能用元素周期律解释的是( )| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>S | ||
| C. | 热稳定性Na2CO3>NaHCO3 | D. | 碱性:NaOH>Mg(OH)2 |
分析 A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.周期元素从左到右,非金属性依次减弱;
C.碳酸氢盐易分解,碳酸盐难分解;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:S>P,则酸性:H2SO4>H3PO4,能用元素周期律解释,故A不选;
B.周期元素从左到右,非金属性依次减弱,则非金属性:Cl>S,能用元素周期律解释,故B不选;
C.碳酸氢盐易分解,碳酸盐难分解,所以热稳定性:Na2CO3>NaHCO3,不能用元素周期律解释,故C选;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,故D不选;
故选C.
点评 本题考查了元素周期律的理解与应用,注意把握元素周期律的递变规律以及相关知识的积累,难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 离子化合物中一定含有金属阳离子 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 在酸碱盐中,碱与盐一定属于离子化合物 | |
| D. | 离子化合物中一定存在离子键 |
4.有关如图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,正确的是( )
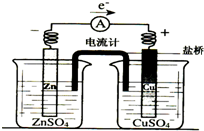

| A. | 铜片上有气泡逸出 | |
| B. | 取出盐桥后,电流计依然发生偏转 | |
| C. | 反应中,盐桥中的K+会移向CuSO4溶液 | |
| D. | 铜片上发生氧化反应 |
14.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 足球烯(C60)在苯中的溶解度比在乙醇中的溶解度大 | C60易溶于非极性溶剂苯而难溶于乙醇,符合相似相溶原理 |
| B | Fe3+可用SCN-检验 | 生成了Fe(SCN)3红色沉淀 |
| C | Cu(OH)2可溶于氨水 | 可生成深蓝色溶液[Cu(H2O)4]SO4 |
| D | HF的沸点高于HCl | HF的键长比HCl短 |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法全不正确的是( )
①CH3-CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法.
①CH3-CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ③⑤ |
18.著名丹麦物理学家尼•玻尔(N.Bohr)将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”,化学方程式可简单表示为:Au+NHO3+3HCl═AuCl3+NO↑+2H2O,AuCl3+HCl═HAuCl4(四氯合金酸).纳粹分子对这种溶液“愚笨”得视而不见、毫无所知.战争结束后,物理学家又根据以下反应,炼出黄金并铸出更加灿烂夺目的奖章:2HAuCl4@2HCl↑+3Cl2↑+2Au.表现出伟大科学家对祖国的无比热爱和非凡智慧.下列叙述中正确的是( )
| A. | 王水能溶解黄金,但不能溶解白金 | |
| B. | HAuCl4具有很强的氧化性 | |
| C. | 盐酸有很强的还原性 | |
| D. | 浓盐酸和浓硝酸按照体积比1:3能配成王水 |
19.实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是( )
| A. | 纯锌与稀硫酸反应 | B. | 纯锌和浓硫酸反应 | ||
| C. | 纯锌与稀盐酸反应 | D. | 粗锌(含铅、铜杂质)与稀硫酸反应 |
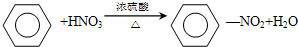 ,属于取代反应;
,属于取代反应; ,属于加成反应;
,属于加成反应; +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应;
+HBr,属于取代反应;