题目内容
19.实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是( )| A. | 纯锌与稀硫酸反应 | B. | 纯锌和浓硫酸反应 | ||
| C. | 纯锌与稀盐酸反应 | D. | 粗锌(含铅、铜杂质)与稀硫酸反应 |
分析 所用稀盐酸和稀硫酸的浓度相同,但硫酸中氢离子浓度大,结合原电池可加快反应速率来解答.
解答 解:浓硫酸与Zn反应不生成氢气;
A、C比较,A中氢离子浓度大,反应速率快,
A、D比较,D中构成原电池,反应速率快,
综上所述,反应速率最快的为D,
故选D.
点评 本题考查化学反应速率的影响因素,为高频考点,把握浓度、原电池对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意浓硫酸的性质,题目难度不大.

练习册系列答案
相关题目
9.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>S | ||
| C. | 热稳定性Na2CO3>NaHCO3 | D. | 碱性:NaOH>Mg(OH)2 |
10.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
| A. | 若原子半径X>Y,则气态氢化物稳定性:HmX<HnY | |
| B. | X、Y一定不是同周期元素 | |
| C. | 由mXa-与nYb-得m+a=n-b | |
| D. | Xa-的还原性一定强于Yb- |
14.已知在1×105Pa、298K的条件下,2mol H2燃烧生成水蒸气时放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1 |
4.下列关于乙烯说法正确的是( )
| A. | 乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同 | |
| B. | 工业利用乙烯水化法制乙醇,是发生了取代反应 | |
| C. | 水果运输中为延长果实的成熟期,常在车厢里放置浸泡过高锰酸钾溶液的硅藻土 | |
| D. | 乙烯在空气中燃烧,发生火焰明亮并带有浓烟的火焰 |
11.有机物 在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤酯化反应 ⑥加聚反应 ⑦缩聚反应.
 在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤酯化反应 ⑥加聚反应 ⑦缩聚反应.
| A. | ①③④ | B. | ②③④⑤ | C. | ④⑤⑥⑦ | D. | ②③④⑤⑦ |
8.下列说法中正确的是( )
| A. | 原子晶体中只含有共价键,离子晶体中只含有离子键 | |
| B. | 原子晶体的熔点一定比金属晶体的高 | |
| C. | 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 | |
| D. | 任何晶体中,若含有阳离子就一定含有阴离子 |
9.关于离子键、共价键等化学键的下列叙述中正确的( )
| A. | 在单质中一定不存在离子键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 化学键断裂一定伴随着化学变化 |
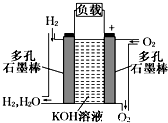 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: