题目内容
18.化学与人们的“衣食住行“,休戚相关.(1)①材料是人类赖以生存的重要物质基础.合金是被广泛应用的金属材料.钢属于铁合金(填“铁合金”或“铝合金”);铁锈蚀主要发生的是电化学腐蚀,其负极反应式为Fe-2e-=Fe2+;无机非金属材料包括玻璃、水泥和陶瓷.
②真丝织品与化纤织品是生活中最常用的面料,下列有关说法不正确的是C.
A.真丝织品中主要含有C,H,O,N四种元素
B.可以用燃烧的方法来区分
C.化纤织品中成分遇到重金属盐,强酸,强碱,有机物等会产生沉淀而失去活性
D.两种产品都属于高分子材料
(2)①我国居民一般尿液偏酸性,平时饮食中应多吃水果(填”肉类”,”几鸡蛋”,”水果”)等碱性食物;微量元素与人体健康密切相关,为了预防碘缺乏,启动了”食盐加碘”,就是在食盐中加适量的碘酸钾.如治疗缺铁性贫血可服用”亚铁丸”(内含有FeSO4,外面裹了一层糖衣),试设计实验判断该亚铁丸是否质刮去药片上的糖衣,把药片碾碎,放入烧杯中,溶解,过滤后向滤液中加入硫氰酸钾,如果溶液变红色,说明已经变质,如果溶液没变红色说明没变质.
②服药时要对症下药,胃舒平(主要成分Al(OH)3)适用于治疗胃酸过多(填”感冒发热”,”细菌感染”,”胃酸过多”).解热镇痛药阿司匹林的结构式为
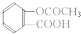
请你写出其中含有的一个官能团的名称羧基.
(3)①汽车尾气(主要有NO等物质)是城市的污染源.治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂.钯合金作催化剂).它的特点是使CO与NO反应,生成无毒气体.写出CO与NO反应的化学方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
②获得洁净安全的饮用水是每个人的正常需要.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉进行杀菌消毒,其原理可用化学方程式表示为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
③奥运期间使用了全生物降解塑料袋,用于餐饮和处理垃圾,而不用传统的高分子材料聚乙烯、聚氯乙烯及聚苯乙烯等,这是为了防止白色污染(填写环境术语).“鸟巢”体育场内,各区座位席的通道口设有专门垃圾箱,箱体上分别用绿色和黑色字样标有“可回收物”和“其他垃圾”,如图图标表示可回收物.

分析 (1)①钢是铁与碳的合金;铁锈蚀主要发生的是电化学腐蚀,其负极发生氧化反应铁失去电子生成二价铁离子;无机非金属材料是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料.常见的有玻璃、水泥、陶瓷等;
②依据真丝织品成分为蛋白质,化纤织品是不添加纯天然纤维材料,纯粹由涤纶、锦纶、氨纶、丙纶、维纶、腈纶、粘胶、尼龙、醋酸纤维、天丝等材料中的一种或几种合成的布料制成的衣物,依据其性质判断解答;
(2)①含钾、钠、钙、镁等矿物质较多的食物,在体内的最终的代谢产物常呈碱性,产生碱性物质的称为碱性食品,蔬菜、水果、乳类、大豆和菌类食物等;加碘盐中添加的为碘酸钾;二价铁离子若变质则被氧化生成三价铁离子,三价铁离子遇到硫氰酸钾显血红色;
②氢氧化铝能够与盐酸反应消耗氢离子;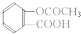 含有羧基和酯基;
含有羧基和酯基;
(3)①CO与NO在催化剂作用下生成氮气和二氧化碳;
②漂白粉与空气接触后,会和二氧化碳水反应生成碳酸钙和次氯酸,次氯酸具有强氧化性,能进行杀菌消毒漂白;
③选用能够降解的塑料袋,为了防止不能降解而带来的环境污染;把垃圾分为可回收物和不可回收物.
解答 解:(1)①钢是铁与碳的合金;
铁锈蚀主要发生的是电化学腐蚀,其负极发生氧化反应铁失去电子生成二价铁离子,电极反应式为:Fe-2e-=Fe2+;
常见的有玻璃、水泥、陶瓷等;
故答案为:铁合金;Fe-2e-=Fe2+;陶瓷;
②A.真丝织品主要成分为蛋白质,主要含有C,H,O,N四种元素,故A正确;
B.真丝制品含有蛋白质灼烧产生烧焦羽毛的气味,化纤织品不具有此性质,故B正确;
C.真丝织品中成分遇到重金属盐,强酸,强碱,有机物等会产生沉淀而失去活性,化纤织品不含蛋白质不具有此性质,故C错误;
D.两种产品都属于高分子材料,故D正确;
故选:C;
(2)①水果为碱性食物;加碘盐是指在食盐中加适量的碘酸钾;二价铁离子若变质则被氧化生成三价铁离子,三价铁离子遇到硫氰酸钾显血红色,所以检验亚铁丸是否变质方法:刮去药片上的糖衣,把药片碾碎,放入烧杯中,溶解,过滤后向滤液中加入硫氰酸钾,如果溶液变红色,说明已经变质,如果溶液没变红色说明没变质;
故答案为:水果;碘酸钾;刮去药片上的糖衣,把药片碾碎,放入烧杯中,溶解,过滤后向滤液中加入硫氰酸钾,如果溶液变红色,说明已经变质,如果溶液没变红色说明没变质;
②氢氧化铝能够与盐酸反应消耗氢离子,所以可以用来治疗胃酸过多;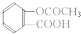 含有羧基和酯基;
含有羧基和酯基;
故答案为:胃酸过多;羧基;
(3)①CO与NO在催化剂作用下生成氮气和二氧化碳,方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
②碳酸酸性强于次氯酸,漂白粉与空气接触后,会和二氧化碳水反应生成碳酸钙和次氯酸,次氯酸具有强氧化性,能进行杀菌消毒漂白,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
③塑料不易降解,影响环境的美观,所含成分有潜在危害,塑料用做包装材料多为白色,往往称为白色污染;可回收物可以重复利用,所以循环图标,
故答案为:白色污染;可回收物.
点评 本题为综合题,考查课生活中常见的化学知识,设计环境污染与治理、生活中常见的材料类型及性质、食品与药物等,题目难度不大,注意对相关知识的积累.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
| A. | 10g H2和10g O2 | B. | 标准状况下相同体积的N2和H2 | ||
| C. | 9g水和0.25mol H2 | D. | 22g CO2和3.01×1023个N2 |

 .
.