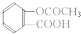题目内容
13.已知下列热化学方程式:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
④C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
回答下列各问题:
(1)上述反应中属于放热反应的是①②③④.
(2)燃烧10g H2生成液态水,放出的热量为1 429.0 kJ.
(3)CO的燃烧热为283.0 kJ•mol-1;其热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1.
分析 (1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应;
(2)由①热化学方程式可知,消耗2g的氢气放出的热量为:285.8kJ;
(3)根据已知的热化学方程式结合盖斯定律计算.
解答 解:(1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应,①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
以上4个反应均为放热反应,故答案为:①②③④;
(2)由①热化学方程式可知,消耗2g的氢气放出的热量为:285.8kJ,所以燃烧10g H2生成液态水,放出的热量为1429.0 kJ,故答案为:1429.0 kJ;
(3)已知③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,
把方程式④-③得:CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△H=-283.0kJ/mol,CO的燃烧热为283.0kJ/mol,
故答案为:283.0kJ/mol;CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△H=-283.0kJ/mol.
点评 本题考查了放热反应的判断、燃烧热的概念应用、盖斯定律的应用,侧重于反应热的计算的考查,题目难度中等.

练习册系列答案
相关题目
4.已知常温下:Ksp(AgCl)=1.8×10-10,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,无沉淀析出 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
1.除去某溶液里溶解的少量杂质(括号内的物质为杂质),下列做法中不正确的是( )
| A. | .NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | .KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| C. | .NaCl溶液(Br2):加CCl4,分液 | |
| D. | .FeSO4溶液(CuSO4):加过量铁粉、过滤 |
8.金属钠引起的火灾,可用下列哪种物质或方法灭火( )
| A. | 泡沫灭火器 | B. | 干粉灭火器 | C. | 水 | D. | 细沙 |
5.能正确表示下列反应的离子方程式是( )
| A. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++SO32-+H2O | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
 50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题: