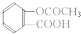题目内容
9.用地壳中硅元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用.例如:(1)目前应用最多的太阳能电池的光电转化材料是晶体硅;
(2)赏心悦目的雕花玻璃是用一种物质对玻璃进行化学刻蚀而制成的,该反应的化学方程式为4HF+SiO2=SiF4↑+2H2O;
(3)工业上制取粗硅是用石英和焦炭在高温电炉中反应制得,该反应中氧化剂与还原剂的质量比为5:2;
用石英和焦炭在高温电炉中反应也可以制得金刚砂(SiC),并产生CO气体,该反应中氧化剂和还原剂的物质的量之比为1:2.
分析 (1)晶体硅为良好的半导体材料;
(2)二氧化硅与氢氟酸反应生成四氟化硅和水;
(3)SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑反应中,Si元素的化合价降低,C元素的化合价升高,SiO2为氧化剂,C是还原剂,SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价,以此计算.
解答 解:(1)晶体硅为良好的半导体材料,是制造太阳能电池的主要原料;
故答案为:晶体硅;
(2)二氧化硅与氢氟酸反应生成四氟化硅和水,方程式:4HF+SiO2=SiF4↑+2H2O;
故答案为:4HF+SiO2=SiF4↑+2H2O;
(3)SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑反应中,Si元素的化合价降低,C元素的化合价升高,SiO2为氧化剂,C是还原剂,由反应可知,物质的量比为1:2,质量比为1×60:2×12=5:2,
SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价,则C为氧化剂,也是还原剂,由电子守恒及原子守恒可知,1molC作氧化剂与2molC作还原剂转移电子相等,则氧化剂和还原剂物质的量之比为1:2,
故答案为:5:2,1:2.
点评 本题考查硅及其化合物性质应用,氧化还原反应及计算,熟悉硅及氧化硅的性质是解题关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
17.下列有关氮元素及其化合物的表示正确的是( )
| A. | 质子数为7、中子数为7的氮原子:${\;}_7^{14}$N | |
| B. | 氮原子的结构示意图: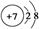 | |
| C. | 氨气分子的电子式: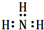 | |
| D. | 对硝基甲苯的结构简式: |
20.已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | 由反应①②可计算出CH3OH的燃烧热 | |
| B. |  反应②中的能量变化如图所示 | |
| C. | 可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ•mol-1 | |
| D. | 可推知CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
17. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
4.已知常温下:Ksp(AgCl)=1.8×10-10,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,无沉淀析出 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
14.按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);.
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$不变
D.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(O{H^-})}}$减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是A.
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”、“=”或“<”)
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);.
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$不变
D.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(O{H^-})}}$减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
1.除去某溶液里溶解的少量杂质(括号内的物质为杂质),下列做法中不正确的是( )
| A. | .NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | .KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| C. | .NaCl溶液(Br2):加CCl4,分液 | |
| D. | .FeSO4溶液(CuSO4):加过量铁粉、过滤 |