��Ŀ����
6�����жԸ���ƽ����ϵ�������У���ȫ��ȷ��һ���ǣ����������ڴ�����Һ�д��ڵĵ���ƽ�⣺CH3COOH?CH3COO-+H+����ˮϡ�ͺ���Һ����������Ũ�Ⱦ���С
�ڳ����£��ڴ�����Һ�м���������CH3COONa���壬��ʹ�����ƽ�������ƶ�
��ij�¶��£��ݻ�һ�����ܱ������н��п��淴Ӧ��X��g��+Y��g��?2Z��g��+W��s������H��0ƽ��������¶ȣ��û�ѧƽ�������ƶ�
���������۵Ŀ��淴Ӧ�У�������������ѹǿ����ʱ����Ӧ�ﵽƽ��
��һ��Ũ�ȵĴ�������Һ��ʹ��̪��Һ��죬��ԭ������Һ�д�������ƽ��
CH3COO-+H2O?CH3COOH+OH-ʹ����Һ�е�c��OH-����c��H+��
����̼��Ƶij����ܽ�ƽ����ϵ�У�����ϡ���ᣬƽ�����ܽ�ķ����ƶ�
�����Ȼ����ij����ܽ�ƽ����ϵ�м���⻯�ع��壬�Ȼ���������ת��Ϊ�⻯��������
| A�� | �٢ڢۢܢ� | B�� | �ڢۢܢݢ� | C�� | �ڢۢݢޢ� | D�� | �٢ڢݢޢ� |
���� �ٴ�����Һ��ˮϡ��ƽ��״̬�µ���Ũ�ȼ�С���¶Ȳ��䣬��Һ�����ӻ��������䣬������������Ũ������
�ڴ�����Һ�м�������ƹ��壬�ܽ���������������Ũ�ȣ�����ƽ��������У�
������ƽ�������ȷ�Ӧ������У�
�ܷ�Ӧǰ���������ʵ������䣬������ѹǿʼ�ղ��䣻
�ݴ�������Һ�д�������������������ӣ����������ˮ����ˮ������������ӣ��ٽ�ˮ�ĵ���ƽ��������У�����������Ũ������
����Ӱ��ƽ���ƶ������أ���С������Ũ�ȣ�ƽ�������ƶ���
������AgCl��AgI���������ʽ��ͬ����KspԽ���ܽ��Խ���ܽ�ȴ����ת��Ϊ�ܽ��С��
��� �⣺���ڴ�����Һ�д��ڵĵ���ƽ�⣺CH3COOH?CH3COO-+H+ ��ˮϡ�ͺ���Һ��������Ũ�Ⱦ���С���¶Ȳ���ˮ�����ӻ����䣬��������������Ũ�ȱ�ʢٴ���
�ڴ�����������������ӣ���������ƣ����������Ũ�ȱ����ƽ���������ƶ����ʢ���ȷ��
��ij�¶��£��ݻ�һ�����ܱ������н��п��淴Ӧ��X��g��+Y��g��?2Z��g��+W��s������H��0����Ӧ�����ȷ�Ӧ��ƽ��������¶ȣ��û�ѧƽ�������ƶ����ʢ���ȷ��
��X��g��+Y��g��?2Z��g��+W��s����H��0�����ߵ�����ļ�����ȣ���Ӧǰ���������ʵ������䣬������ѹǿʼ�ղ��䣬ѹǿ���䲻��˵����Ӧ�ﵽƽ��״̬���ʢܴ���
�ݴ�������Һ�д�������������������ӣ����������ˮ����ˮ������������ӣ��ٽ�ˮ�ĵ���ƽ��������У�����������Ũ������CH3COO-+H2O?CH3COOH+OH-ʹ����Һ�е�c ��OH-����c��H+�����ʢ���ȷ��
��̼��Ƶij����ܽ�ƽ����ϵ�У�����ϡ���ᣬ����̼���Ũ�ȣ�ƽ�������ƶ��������ܽ�ķ����ƶ����ʢ���ȷ��
������AgCl��AgI���������ʽ��ͬ����KspԽ���ܽ��Խ���ܽ�ȴ����ת��Ϊ�ܽ��С�ģ���ΪKSP��AgCl������KSP��AgI������AgI���ܽ��С�������Ȼ���������ת��ΪAgI��ɫ�������ʢ���ȷ��
��ѡC��
���� ������ض�ѧ������֪ʶ�Ĺ��̺�ѵ������Ҫ�ǿ���ѧ��������ƽ��״̬�Լ����������ƽ��״̬Ӱ����˽�̶ȣ�����������ѧ�������������������ѧ��������û���֪ʶ���ʵ�����������������������ѧ����ѧ�������������Ǹ߿��еij������㣬�����е��Ѷ�����Ŀ��飬�����ۺ���ǿ��

 ��У����ϵ�д�
��У����ϵ�д� NO2��O2������KNO3������ȼ�ϵ�أ���ԭ����ͼ��ʾ���õ���ڷŵ������ʯīI�缫������������Y��Y��ѭ��ʹ�ã�����˵����ȷ���ǣ�������
NO2��O2������KNO3������ȼ�ϵ�أ���ԭ����ͼ��ʾ���õ���ڷŵ������ʯīI�缫������������Y��Y��ѭ��ʹ�ã�����˵����ȷ���ǣ�������| A�� | O2��ʯī������������Ӧ�ŵ�ʱ��NO3-��ʯī��缫Ǩ�� | |
| B�� | ʯī���������ķ�Ӧ��NO+O2+e-=NO3 | |
| C�� | ��ص��ܷ�ӦʽΪ��4NO2+O2=2N2O5 | |
| D�� | �����·ͨ��4mole-�������Ϲ�����2molN2O5 |
 ijʵ��С����0.50mol/L NaOH��Һ��0.50mol/L������Һ�����к��ȵIJⶨ��
ijʵ��С����0.50mol/L NaOH��Һ��0.50mol/L������Һ�����к��ȵIJⶨ��������0.50mol/L NaOH��Һ
��ʵ���д�ԼҪʹ��245mL NaOH��Һ��������Ҫ����NaOH����5.0g
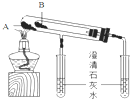
�ⶨϡ�����ϡ���������к��ȵ�ʵ��װ������ͼ��ʾ��
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ���к���Ϊ57.3kJ/mol����$\frac{1}{2}$H2SO4��aq��+NaOH��aq��=$\frac{1}{2}$Na2SO4��aq��+H2O��l����H=-57.3kJ/mol
��2��ȡ50mL NaOH��Һ��30mL������Һ����ʵ�飬ʵ���������±���
������д�±��еĿհף�
| �� �¶� ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
������ʵ����ֵ�����57.3kJ/mol��ƫ�����ƫ���ԭ�������acd������ĸ��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶ȣ�
��1��ʵ���ҳ���NaOH��Һ������ϴ�����ᴿ����100mL3mol/L��NaOH��Һ���ձ�״����4.48LCO2ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊc��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+������
��2����������һ�������0.1mol/L������Һ�м�ˮϡ�ͺ�����˵����ȷ����CD��
A����Һ�е������ӵ���Ŀ��С
B������ĵ���̶�����c��H+��������
C����Һ��$\frac{{c��C{H_3}CO{O^-}��}}{{c��C{H_3}COOH��•c��O{H^-}��}}$����
D����Һ��$\frac{{c��C{H_3}CO{O^-}��}}{{c��O{H^-}��}}$��С
��3���ٳ����½�0.15mol/Lϡ����V1mL��0.1mol/LNaOH��ҺV2mL��ϣ�������Һ��pHΪ1����V1��V2=1��1����Һ����仯���Բ��ƣ���
�ڳ���������Һ��pH=3��HA��ҺV1mL��pH=11��NaOH��ҺV2mL��϶��ã�������˵����ȷ����
A������Ӧ����Һ�����ԣ���c��H+��+c��OH-��=2��10-7mol/L
B����V1=V2����Ӧ����ҺpHһ������7
C������Ӧ����Һ�����ԣ���V1һ������V2
D������Ӧ����Һ�ʼ��ԣ���V1һ��С��V2
��4�������£�Ũ�Ⱦ�Ϊ0.1mol/L������������Һ��pHֵ�����ʾ��
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A��HCN B��HClO C��H2CO3 D��CH3COOH
�ڸ����������ݣ��ж����з�Ӧ���Գ�������AB��
A��CH3COOH+Na2CO3�TNaHCO3+CH3COONa
B��CH3COOH+NaCN�TCH3COONa+HCN
C��CO2+H2O+2NaClO�TNa2CO3+2HClO
D��NaHCO3+HCN�TNaCN+CO2+H2O
��5���������ӿ�ʼ����ʱ��pH�����
| ���� | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
| A�� | ��NaCl��Һ��BaCl2�����ӹ���Na2CO3��Һ�����ˣ��ټ��������Ტ���� | |
| B�� | ��KNO3��Һ��AgNO3�����ӹ���KCl��Һ������ | |
| C�� | ��NaCl��Һ��Br2������CCl4����Һ | |
| D�� | ��FeSO4��Һ��CuSO4�����ӹ������ۡ����� |
| A�� | �Ȼ�����Һ | B�� | ������������ | C�� | ���� | D�� | ����ͭ��Һ |
 Na2CO3��NaHCO3�����ֳ��������Σ�
Na2CO3��NaHCO3�����ֳ��������Σ�

 ���÷�Ӧ�У�����������Cl2����ԭ������Cl2�����������뻹ԭ��������ʵ���֮����5��1��
���÷�Ӧ�У�����������Cl2����ԭ������Cl2�����������뻹ԭ��������ʵ���֮����5��1��