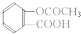题目内容
8.FeSO4•7H2O俗称“绿矾”,是一种蓝绿色晶体.某课外活动小组同学在实验室发现一瓶绿矾已部分变质,拟用该试剂为原料,重新制取FeSO4•7H2O晶体,并测定其纯度.[查阅资料]
①绿矾化学性质常不稳定,在潮湿空气中F逐渐氧化变质,久置的绿矾溶液逐渐变为黄
色,并出现棕黄色浑浊;
②硫酸亚铁的溶解度随温度升高而增大.
[制备晶体]
①取一定量已变质的“绿矾”于烧杯中,加适量水,搅拌,得到棕黄色悬浊液.
②加入一定量稀H2SO4和过量铁屑,在60℃左右水浴中加热,充分反应,待溶液完全
变为浅绿色为止.
③趁热过滤,并用少量热水洗涤,将滤液转入到密闭容器中,静置、冷却结晶.
④待结晶完毕后,过滤出晶体,用少量冰水洗涤,再用滤纸吸干水分,最后放人广口瓶
中密闭保存.
请回答下列问题:
(1)完成久置绿矾溶液在空气中变质反应的离子方程式:
□Fe2++□O2+□6H2O═□Fe3++□4Fe(OH)3↓
(2)实验步骤②中加入稀硫酸的目的是溶解Fe(OH)3沉淀,防止FeSO4水解
(3)实验步骤③中趁热过滤目的是减少过滤时FeSO4损失.
(4)实验中两次用到过滤操作,完成该操作的玻璃仪器有烧杯、玻璃棒、漏斗.
[测定纯度]
有同学认为,制备过程中可能有少量Fe2+被氧化为Fe3+,导致产品不纯.他们设计了如下方案测定产品的纯度.

请回答下列问题:
限选试剂:NaOH溶液、KSCN溶液、H2O2溶液、苯酚稀溶液、K3[Fe(CN)6]溶液、BaCl2溶液
(5)检验产品中是否含有Fe3+的无机试剂最好是:KSCN溶液.
(6)试剂X是:K3[Fe(CN)6]溶液.
(7)产品中FeSO4•7H2O(摩尔质量为278g/mol)的含量为:$\frac{417{m}_{2}}{296{m}_{1}}$×100%(用质量分数表示).
分析 (1)久置的绿矾溶液逐渐变为黄色,并出现棕黄色浑浊,说明亚铁离子被氧化为铁离子和氢氧化铁沉淀,反应物是铁和氧气、水发生反应生成铁离子、氢氧化铁,结合电荷守恒和原子守恒配平书写;
(2)加入一定量稀H2SO4和过量铁屑,用于溶解氢氧化铁,铁和铁离子反应生成亚铁离子,硫酸可以抑制亚铁离子的水水解;
(3)②加入一定量稀H2SO4和过量铁屑,在60℃左右水浴中加热,充分反应,待溶液完全变为浅绿色为止,③趁热过滤,并用少量热水洗涤,将滤液转入到密闭容器中,静置、冷却结晶,温度太低会析出晶体,实验步骤③中趁热过滤目的防止硫酸亚铁损失;
(4)依据过滤装置分析仪器;
(5)检验铁离子用KSCN溶液,铁离子遇到KSCN溶液变血红色;
(6)m1g产品加入水和稀硫酸溶解得到溶液,在溶液中加入足量试剂X过滤得到m2固体判断试剂X应是错的亚铁离子的试剂K3[Fe(CN)6]溶液;
(7)依据铁元素守恒计算.
解答 (1)久置的绿矾溶液逐渐变为黄色,并出现棕黄色浑浊,说明亚铁离子被氧化为铁离子和氢氧化铁沉淀,反应物是铁和氧气、水发生反应生成铁离子、氢氧化铁,结合电荷守恒和原子守恒配平书写得到离子方程式为:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓,
故答案为:12;3;6;H2O;8;4;Fe(OH)3↓;
(2)加入一定量稀H2SO4和过量铁屑,在60℃左右水浴中加热,充分反应,待溶液完全变为浅绿色为止得到硫酸亚铁溶液,加入稀硫酸的目的是溶解Fe(OH)3沉淀,防止FeSO4水解,
故答案为:溶解Fe(OH)3沉淀,防止FeSO4水解;
(3)温度太低会析出晶体,所以要趁热过滤,减少过滤时FeSO4损失,
故答案为:减少过滤时FeSO4损失;
(4)实验中两次用到过滤操作,完成该操作的玻璃仪器有烧杯、玻璃棒、漏斗,
故答案为:玻璃棒、漏斗;
(5)检验产品中是否含有Fe3+的无机试剂最好是KSCN溶液,所以检验铁离子用KSCN溶液,铁离子遇到KSCN溶液变血红色,
故答案为:KSCN溶液;
(6)m1g产品加入水和稀硫酸溶解得到溶液,在溶液中加入足量试剂X过滤得到m2固体判断试剂X应是错的亚铁离子的试剂K3[Fe(CN)6]溶液,
故答案为:K3[Fe(CN)6]溶液;
(7)m1g产品加入水和稀硫酸溶解得到溶液,在溶液中加入足量试剂X过滤得到m2固体为Fe3[Fe(CN)6]2,依据铁元素守恒得到产品中FeSO4•7H2O(摩尔质量为278g/mol)的含量=$\frac{\frac{{m}_{2}g}{592g/mol}×3×278g/mol}{{m}_{1}}$×100%=$\frac{417{m}_{2}}{296{m}_{1}}$×100%,
故答案为:$\frac{417{m}_{2}}{296{m}_{1}}$×100%.
点评 本题考查了物质组成的探究和组成的实验探究,物质含量的测定,主要是离子性质的分析和检验方法,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A | B | C | D |
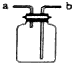 |  | 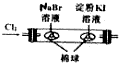 | 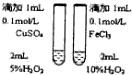 |
| 用该装置排空气法收集H2、CO2、Cl2等气体 | 蒸干AlCl3饱和溶液制备AlCl3晶体 | 可以证明氧化性Cl2>Br2>I2 | 比较不同催化剂对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 质子数为7、中子数为7的氮原子:${\;}_7^{14}$N | |
| B. | 氮原子的结构示意图: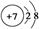 | |
| C. | 氨气分子的电子式: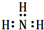 | |
| D. | 对硝基甲苯的结构简式: |
 NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示,该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示,该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A. | O2在石墨Ⅱ附近发生氧化反应放电时,NO3-向石墨Ⅱ电极迁移 | |
| B. | 石墨Ⅱ极附近发生的反应:NO+O2+e-=NO3 | |
| C. | 电池的总反应式为:4NO2+O2=2N2O5 | |
| D. | 当外电路通过4mole-,负极上共产生2molN2O5 |
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | 由反应①②可计算出CH3OH的燃烧热 | |
| B. |  反应②中的能量变化如图所示 | |
| C. | 可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ•mol-1 | |
| D. | 可推知CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题: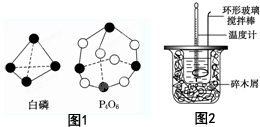 (1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.
(1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.