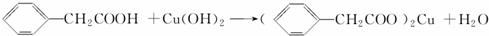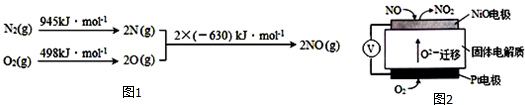题目内容
8.(1)通常用饱和NaHCO3溶液除去混在CO2中少量的HCl气体,其反应的离子方程式为H++HCO3-=H2O+CO2↑,不能用NaOH溶液的原因是(用离子方程式表示)CO2+2OH-=H2O+CO32-,也不能用Na2CO3溶液的原因是(用离子方程式表示)CO2+CO32-+H2O=2HCO3-.(2)向饱和Na2CO3溶液中通入过量的CO2气体,发生反应的离子方程式为2Na++CO32-+H2O+CO2=2NaHCO3↓.
分析 (1)氯化氢能够与饱和碳酸氢钠溶液反应生成氯化钠、二氧化碳和水;氢氧化钠溶液能够与二氧化碳反应生成碳酸钠和水;碳酸钠溶液与二氧化碳反应生成碳酸氢钠;
(2)碳酸钠溶液与二氧化碳反应生成碳酸氢钠,碳酸钠溶解度大于碳酸氢钠.
解答 解:(1)氯化氢能够与饱和碳酸氢钠溶液反应生成氯化钠、二氧化碳和水,反应的离子方程式:H++HCO3-=H2O+CO2↑,所以可以用饱和碳酸氢钠除去二氧化碳中的氯化氢;氢氧化钠溶液能够与二氧化碳反应生成碳酸钠和水,离子方程式:CO2+2OH-=H2O+CO32-;碳酸钠溶液与二氧化碳反应生成碳酸氢钠,离子方程式:
CO2+CO32-+H2O=2HCO3-;
故答案为:饱和NaHCO3溶液;H++HCO3-=H2O+CO2↑;CO2+2OH-=H2O+CO32-;CO2+CO32-+H2O=2HCO3-;
(2)向饱和Na2CO3溶液中通入足量CO2,发生反应Na2CO3+CO2+H2O=2NaHCO3,Na2CO3溶解度大于NaHCO3,则NaHCO3溶液为过饱和溶液,所以生成NaHCO3沉淀导致溶液变浑浊,离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓;
故答案为:2Na++CO32-+H2O+CO2=2NaHCO3↓.
点评 本题考查了物质的提纯,明确除杂原则:不能引入新杂质是解题关键,题目难度不大,注意碳酸钠与碳酸氢钠的性质.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
18.下面是有关弱酸的电离平衡常数
结合数据,分析下列有关说法,其中错误的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 1mol•L-1的溶液中,pH(HCN)>pH(H2CO3)>pH(CH3COOH) | |
| B. | 升高温度,HCN溶液中HCN的电离平衡正向移动,电离平衡常数增大 | |
| C. | 0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比小于2:1 | |
| D. | 饱和H2CO3溶液中c(H+)与c(CO32-)的比值小于2:1 |
3.下列各组选项按照电解质-→非电解质-→单质-→混合物顺序排列的一项是( )
| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
13.(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下
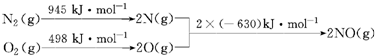
写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol.
(2)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236KJ/molkJ/mol.(1 molSi有2molSi-Si)
(3)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=△H1+3△H2+18△H3.
(4)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H2=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.84kJ•mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.

写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol.
(2)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(3)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=△H1+3△H2+18△H3.
(4)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H2=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.84kJ•mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
20.已知断开或形成1mol化学键吸收或放出的能量称为化学键的键能,如H-H键的键能为436kJ•mol-1,N≡N键的键能为945kJ•mol-1,N-H键的键能为391kJ•mol-1.则下列有关工业合成氨反应的热化学方程式正确的是
( )
( )
| A. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-93 kJ•mol-1 | |
| B. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+1471 kJ•mol-1 | |
| C. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+93 kJ•mol-1 | |
| D. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-1471 kJ•mol-1 |
17.将新制氯水注入KI溶液中充分反应后,再加CCl4,振荡后静置,看到的现象是( )
| A. | 液体均一,呈紫红色 | |
| B. | 液体分两层,上层为紫红色,下层为无色 | |
| C. | 液体分两层,上层为无色,下层为紫红色 | |
| D. | 液体均一,呈无色 |
18.平衡常数的大小可以表示反应进行的程度,平衡常数越大,说明( )
| A. | 反应物平衡浓度较大 | B. | 反应越有利于往逆反应方向进行 | ||
| C. | 反应进行的越彻底 | D. | 生成物平衡浓度较小 |
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: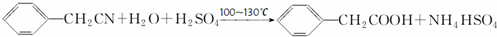 ;
;