题目内容
20.已知断开或形成1mol化学键吸收或放出的能量称为化学键的键能,如H-H键的键能为436kJ•mol-1,N≡N键的键能为945kJ•mol-1,N-H键的键能为391kJ•mol-1.则下列有关工业合成氨反应的热化学方程式正确的是( )
| A. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-93 kJ•mol-1 | |
| B. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+1471 kJ•mol-1 | |
| C. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+93 kJ•mol-1 | |
| D. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-1471 kJ•mol-1 |
分析 反应的反应热△H=反应物的键能-生成物的键能,据此分析.
解答 解:由于反应的反应热△H=反应物的键能-生成物的键能,故反应N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=945kJ•mol-1+3×436kJ•mol-1-6×391kJ•mol-1=-93KJ/mol,故选A.
点评 本题考查了反应热的有关计算,应注意的是反应热△H=反应物的键能-生成物的键能,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列说法中,不正确的是( )
| A. | 用渗析的方法制制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | ${\;}_{8}^{18}$O2-离子结构示意图 | |
| D. | 冰酸酸、铝热剂、硫酸钡、SO2分别屈于酸、混合物、强电解质、非电解质 |
12.短周期元素W、X、Y、Z在元素周期表中的位置如表所示,其中Z的单质,是一种重要半导体材料.广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位位置是第二周期第ⅣA族
(2)Z的原子结构示意图为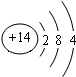
(3)X和Y离子半径最大的是N3-(填离子符号)
(4)下列选项中.能证明元素非佥属性X强于W的是CD
A.原子序数:W>X B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(5)写出表中Y的最高价氧化物对应水化物的电离方程式Mg(OH)2?Mg2++2OH-
(6)元素周期表中与同Z同期的某金属元素形成的单质A,可发生如图所示的转化
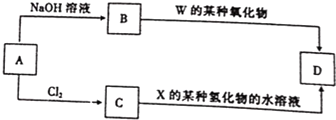
其中化含物D是-种白色沉淀,则生成物B的化学式为NaAlO2,C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| W | X | ||
| Y | Z |
(2)Z的原子结构示意图为

(3)X和Y离子半径最大的是N3-(填离子符号)
(4)下列选项中.能证明元素非佥属性X强于W的是CD
A.原子序数:W>X B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(5)写出表中Y的最高价氧化物对应水化物的电离方程式Mg(OH)2?Mg2++2OH-
(6)元素周期表中与同Z同期的某金属元素形成的单质A,可发生如图所示的转化

其中化含物D是-种白色沉淀,则生成物B的化学式为NaAlO2,C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
10.组成和结构可用 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )
 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )| A. | 16种 | B. | 18种 | C. | 20种 | D. | 22种 |
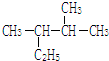 用系统命名法命名:2,3-二甲基戊烷;
用系统命名法命名:2,3-二甲基戊烷;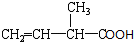 含氧官能团的名称是羧基;
含氧官能团的名称是羧基; ;
; ;
; .
.