题目内容
3.下列各组选项按照电解质-→非电解质-→单质-→混合物顺序排列的一项是( )| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
分析 电解质是指在水溶液里或熔化状态下能够导电的化合物;非电解质是指在水溶液里和熔化状态下都不能够导电的化合物;单质是同种元素组成的纯净物;混合物是由不同物质组成的,据此可以分析各个选项中各种的所属类别.
解答 解:A、HCl、SO3、石墨、液氧分别属于电解质、非电解质、单质、单质,故A错误;
B、NaCl、乙醇、铁、空气分别属于电解质、非电解质、单质、混合物,故B正确;
C、蔗糖、CuSO4、氮气、波尔多液分别属于非电解质、电解质、单质、混合物,故C错误;
D、KCl、NaNO3、氯气、石灰水分别属于电解质、电解质、单质、混合物,故D错误;
故选:B.
点评 本题主要考查了有关概念,应抓住概念的要点来判断物质的类别,了解常见物质的组成.

练习册系列答案
相关题目
13.将一定质量的Mg、Al混合物与足量稀H2SO4反应,生成H2 11.2L(标准状况),原混合物的质量可能是( )
| A. | 2g | B. | 4g | C. | 8g | D. | 10g |
14.下列变化,必须要加入氧化剂才能实现的是( )
| A. | HCl→H2 | B. | H2O2→O2 | C. | H2SO4→SO2 | D. | Fe→Fe3O4 |
12.短周期元素W、X、Y、Z在元素周期表中的位置如表所示,其中Z的单质,是一种重要半导体材料.广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位位置是第二周期第ⅣA族
(2)Z的原子结构示意图为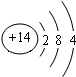
(3)X和Y离子半径最大的是N3-(填离子符号)
(4)下列选项中.能证明元素非佥属性X强于W的是CD
A.原子序数:W>X B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(5)写出表中Y的最高价氧化物对应水化物的电离方程式Mg(OH)2?Mg2++2OH-
(6)元素周期表中与同Z同期的某金属元素形成的单质A,可发生如图所示的转化
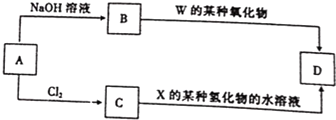
其中化含物D是-种白色沉淀,则生成物B的化学式为NaAlO2,C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| W | X | ||
| Y | Z |
(2)Z的原子结构示意图为

(3)X和Y离子半径最大的是N3-(填离子符号)
(4)下列选项中.能证明元素非佥属性X强于W的是CD
A.原子序数:W>X B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(5)写出表中Y的最高价氧化物对应水化物的电离方程式Mg(OH)2?Mg2++2OH-
(6)元素周期表中与同Z同期的某金属元素形成的单质A,可发生如图所示的转化

其中化含物D是-种白色沉淀,则生成物B的化学式为NaAlO2,C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
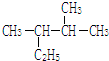 用系统命名法命名:2,3-二甲基戊烷;
用系统命名法命名:2,3-二甲基戊烷;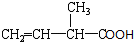 含氧官能团的名称是羧基;
含氧官能团的名称是羧基;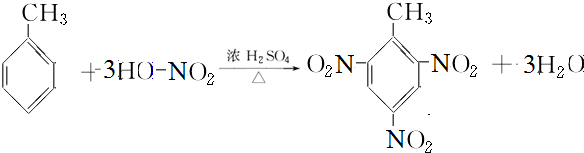 ;
; ;
;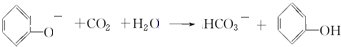 .
.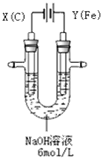 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.