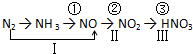题目内容
18.下面是有关弱酸的电离平衡常数| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 1mol•L-1的溶液中,pH(HCN)>pH(H2CO3)>pH(CH3COOH) | |
| B. | 升高温度,HCN溶液中HCN的电离平衡正向移动,电离平衡常数增大 | |
| C. | 0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比小于2:1 | |
| D. | 饱和H2CO3溶液中c(H+)与c(CO32-)的比值小于2:1 |
分析 酸的电离平衡常数越大,酸的酸性越强,根据电离平衡常数知,酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3-,
A.酸的电离平衡常数越小,相同浓度时氢离子浓度越小,则溶液的pH越大;
B.升高温度,促进弱电解质电离;
C.醋酸的浓度越大,电离程度越小;
D.碳酸分两步电离H2CO3?H++HCO3-、HCO3-?H++CO32-,第一步远远大于第二步电离
解答 解:酸的电离平衡常数越大,酸的酸性越强,根据电离平衡常数知,酸性强弱顺序为CH3COOH>H2CO3>HCN>HCO3-,
A.酸的电离平衡常数越小,相同浓度时溶液中氢离子浓度越小,则溶液的pH越大,所以1mol•L-1的溶液中pH(HCN)>pH(H2CO3)>pH(CH3COOH),故A正确;
B.升高温度,促进弱电解质电离,所以升高温度促进HCN电离,c(H+)增大,电离平衡常数增大,故B正确;
C.0.2mol/L醋酸溶液与0.1mol/L醋酸溶液,前者醋酸的电离程度大于后者,则两溶液中c(H+)之比小于2:1,故C正确;
D.碳酸分两步电离H2CO3?H++HCO3-、HCO3-?H++CO32-,第一步远远大于第二步电离,所以饱和H2CO3溶液中c(H+)与 c(CO32-)的比值大于2:1,故D错误;
故选D.
点评 本题考查了弱电解质的电离,题目难度中等,明确酸的电离平衡常数与酸性强弱的关系为解答关键,注意熟练掌握弱电解质的电离平衡及其影响,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.在高温和催化剂的作用下,向容积为2L的密闭容器加入0.2mol的CO和0.2mol的H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=a kJ/mol(a>0).达到平衡后,测得c(CO):c(CO2)=3:2.下列说法正确的是( )
| A. | 反应放出的热量为0.2akJ | |
| B. | 平衡时H2O的转化率为60% | |
| C. | 升高温度,v(正)加快v(逆)减慢,平衡正向移动 | |
| D. | 将容器的体积压缩为1L,H2的体积分数变为60% |
9.在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,平衡向正反应方向移动,c(H+)增大 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动,c(H+)减少 | |
| C. | 加入少量0.1mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动,c(CH3COO-)增大 |
13.将一定质量的Mg、Al混合物与足量稀H2SO4反应,生成H2 11.2L(标准状况),原混合物的质量可能是( )
| A. | 2g | B. | 4g | C. | 8g | D. | 10g |