题目内容
13.(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下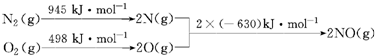
写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol.
(2)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(3)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=△H1+3△H2+18△H3.
(4)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H2=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.84kJ•mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
分析 (1)根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
(3)化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和.在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,所以每个硅原子含有2个共价键;
(4)可以运用盖斯定律来计算化学反应的焓变;
(5)依据热化学方程式和盖斯定律计算得到;
解答 解:(1)该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1;
故答案为:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol;
(3)反应热=反应物的键能之和-生成物的键能之和,即△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol,故答案为:+236KJ/mol;
(4)热化学方程式4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4可以将下列三个反应相加得到:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1;6Ca3(PO4)2(s)+30C(s)=3P4(g)+18CaO(s)+30CO(g)3△H2;18SiO2(s)+18CaO(s)=18CaSiO3(s)18△H3;根据盖斯定律可得△H=△H1+3△H2+18△H3,
故答案为:△H1+3△H2+18△H3;
(5)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ/mol
依据盖斯定律①+$\frac{1}{2}$②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol;
故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol;
点评 本题考查了热化学方程式的计算书写,盖斯定律的计算应用,题目难度中等.注意基础的掌握.

| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
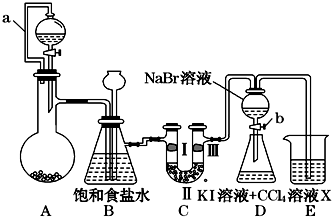 某同学设计如图所示的实验方案:
某同学设计如图所示的实验方案:(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr2O7),还原产物是CrCl3,写出A中离子方程式:Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O.
(2)本实验目的是制备氯气并探究氯气等物质的相关性质,B装置有几个作用,分别是除去氯气中的氯化氢、安全瓶,检测实验过程中装置是否堵塞.拆去a导管的后果可能是酸不能顺利滴入烧瓶.
(3)装置C的功能是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是②.
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
(5)D装置进行实验时存在明显不足,它是没有排除氯气对溴单质与KI反应的干扰,合适的溶液X是①④⑥ (从①氢氧化钠溶液②亚硫酸钠溶液③亚硫酸氢钠溶液④氯化亚铁溶液⑤硫氢化钠溶液⑥碳酸氢钠溶液中选择).
| A. | 用渗析的方法制制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | ${\;}_{8}^{18}$O2-离子结构示意图 | |
| D. | 冰酸酸、铝热剂、硫酸钡、SO2分别屈于酸、混合物、强电解质、非电解质 |
| A. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Na2O2与H2O反应制备O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+3Cl2═2Fe3++Br2+6Cl- |
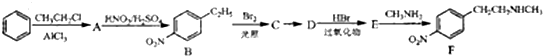
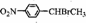 .
.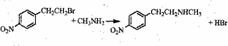 .
.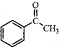 )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线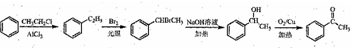 .
.