题目内容
9.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 常温下,46 g分子式为C2H6O的物质中一定含有极性键为7NA,非极性键为NA | |
| C. | 125 mL 16 mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA | |
| D. | 标准状况下,体积为22.4 L NO2、N2O4的混合气体,升温至常温,则混合气体分子数为NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、分子式为C2H6O的物质可能为乙醇,也可能是二甲醚;
C、铜只能与浓硫酸反应,也稀硫酸不反应;
D、NO2、N2O4的混合气体中存在平衡:2NO2?N2O4,正反应方向吸热.
解答 解:A、常温时气体摩尔体积大于22.4L/mol,所以33.6LCl2的物质的量小于15 mol,故转移的电子数少于3 NA,故A错;
B、C2H6O有二种可能的结构CH3-CH2-OH和CH3-O-CH3,没有非极性键,故B错;
C、浓H2SO4在反应过程中会逐渐变稀,与铜的反应即停止,即浓硫酸不能反应完全,则生成的二氧化硫分子个数小于NA个,故C正确;
D、NO2、N2O4的混合气体中存在平衡:2NO2?N2O4,正反应方向吸热,在升温时,平衡向生成NO2的方向移动,分子数增多,故D错.
故选C、
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
19.下列各种关于酸的使用,其中正确的是( )
| A. | 检验氯乙烷中的氯元素,水解后再用硫酸酸化 | |
| B. | 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化 | |
| C. | 为了抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 检验溶液中是否含有SO42-时,先用盐酸酸化 |
20.质量反应的离子方程式书写正确的是( )
| A. | 氢氧化镁与稀盐酸反应:H++OH-═H2O | |
| B. | 氯化钡溶液与硫酸钠溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+ | |
| D. | 碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20 |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子数目为0.4NA | |
| C. | 1 L 1 mol?•L-1 FeCl3完全水解生成NA个胶体粒子 | |
| D. | 含2 mol H2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生NA个SO2气体分子 |
1.能量变化大致趋势符合图能的变化过程的是( )
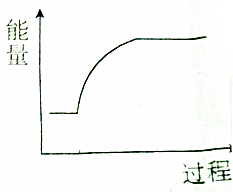

| A. | 钠与水反应 | B. | 钠的熔化过程 | ||
| C. | 氢氧化钠溶液与稀盐酸反应 | D. | Na2O2+H2O→NaOH+O2(未配平) |
18.西维因(结构简式为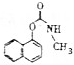 )在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(
)在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(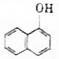 )合成西维因的反应:
)合成西维因的反应:
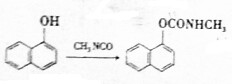
下列说法正确的是( )
 )在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(
)在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚( )合成西维因的反应:
)合成西维因的反应:
下列说法正确的是( )
| A. | 该反应为加成反应 | |
| B. | 可用FeCl3溶液检验萘酚是否完全反应 | |
| C. | 萘酚与苯酚互为同系物 | |
| D. | 1mol西维因最多能与2molNaOH反应 |
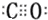 .
.
 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.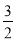 O2(g)
O2(g) 2H2O(l)+CO(g)ΔH1
2H2O(l)+CO(g)ΔH1