题目内容
17.按要求回答下列问题:(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云形象化描述;在基态14C原子中,核外存在2对自旋相反的电子.
(2)在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接12个六元环,六元环中最多有4个C原子在同一平面,一个金刚石晶胞平均占有碳原子个数为8.
(3)与N2互为等电子体的分子是CO,该分子的电子式为
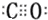 .
.(4)己知C60分子结构如图1所示:
该笼状分子是由多个正六边形和正五边形组成的,面体的顶点数V、面数F及棱数E间关系为:V+F-E=2,则此分子中共有12个正五边形.
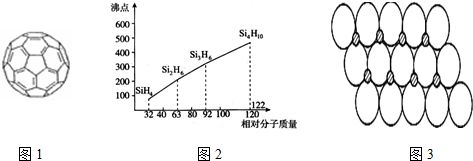
(5)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图2所示,呈现这种变化的原因是硅烷的相对分子质量越大,分子间范德华力越强,熔沸点越高.
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为$\frac{\sqrt{2}}{2}$a cm(用含有a的代数式表示),在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图3),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为1.83×10-3g(氧离子的半径为1.40×10-10m ).
分析 (1)电子云形象的描述了一定空间运动状态的电子在原子核外出现的概率密度分布;
基态14C原子的核外电子排布为1s22s22p2,1s、2s为成对电子,自旋方向相反,2p能级为单电子,自旋方向相同;
(2)一个碳原子有四个共价键,其中任意两条边(共价键)可以构成2个不同的六元环,根据组合知识可知四条边任选其中两条有6组;六元环中有两条边平衡,连接的原子处于同一平面内;金刚石晶胞中有4个原子处于晶胞内部,其它碳原子处于顶点与面心,利用均摊法计算;
(3)原子总数相等、价电子总数也相等的微粒互为等电子体,等电子体结构相似;
(4)C60分子中每个碳原子只跟相邻的3个碳原子相连,每条棱为1个C原子提供$\frac{1}{2}$,可得棱的数目,而单键与双键数目之和等于棱数,每个碳原子形成2个单键、1个双键,而每个五边形含有5个单键;
(5)硅烷(SinH2n+2)为分子晶体,相对分子质量越大,分子间作用力越强,沸点越高;
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为$\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的$\sqrt{2}$倍;
根据图片知,每个氧化镍所占的面积=(2×1.40×10-10m)×(2×1.40×10-10m×sin60°),每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
解答 解:(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云形象化描述;基态14C原子的核外电子排布为1s22s22p2,1s、2s为成对电子,自旋方向相反,2p能级为单电子,自旋方向相同,核外存在2对自旋相反的电子,
故答案为:电子云;2;
(2)一个碳原子有四个共价键,其中任意两条边(共价键)可以构成2个不同的六元环,根据组合知识可知四条边任选其中两条有6组,故每个碳原子连接六元环数目为6×2=12,六元环中有两条边平衡,连接的4个原子处于同一平面内,金刚石晶胞中有4个原子处于晶胞内部,其它碳原子处于顶点与面心,晶胞中含有碳原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,
故答案为:12;4;8;
(3)与N2互为等电子体的分子是CO,二者结构相似,CO分子的电子式为  ,
,
故答案为:CO;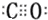 ;
;
(4)C60分子中每个碳原子只跟相邻的3个碳原子相连,每条棱为1个C原子提供$\frac{1}{2}$,可得棱的数目为$\frac{60×3}{2}$=90,而单键与双键数目之和等于棱数,每个碳原子形成2个单键、1个双键,则晶体中单键数目为90×$\frac{2}{3}$=60,而每个五边形含有5个单键,则含有五边形数目为$\frac{60}{5}$=12,
故答案为:12;
(5)硅烷(SinH2n+2)为分子晶体,硅烷的相对分子质量越大,分子间范德华力越强,熔沸点越高,
故答案为:硅烷的相对分子质量越大,分子间范德华力越强,熔沸点越高;
(6)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为$\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的$\sqrt{2}$倍,所以其距离是 $\frac{\sqrt{2}}{2}$acm;
根据图片知,每个氧化镍所占的面积=(2×1.40×10-10m)×(2×1.40×10-10m×sin60°)=4×1.40×10-10×1.40×10-10×sin60°m2,则每平方米含有的氧化镍个数=$\frac{1}{4×1.4×1{0}^{-10}×1.4×1{0}^{-10}×sin60°}$,每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,所以每平方米含有的氧化镍质量=$\frac{74.7}{{N}_{A}}$g×$\frac{1}{4×1.4×1{0}^{-10}×1.4×1{0}^{-10}×sin60°}$=1.83×10-3,
故答案为:$\frac{\sqrt{2}}{2}$a;1.83×10-3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、等电子体、晶胞计算结构与计算等,侧重考查晶胞有关问题,(2)中注意识记中学常见晶胞结构,(5)中注意计算“1NiO”的体积应包含孔隙体积,需要学生具备一定的空间想象与数学计算能力,掌握均摊法进行晶胞有关计算,难度较大.

| A. | 麻黄碱适应于医治因葡萄球菌和链球菌引起的血毒症 | |
| B. | 胃酸过多,出现反胃、吐酸等现象时,可服用小苏打 | |
| C. | 感冒发热头痛时,服用阿司匹林 | |
| D. | 因葡萄球菌等引起的发炎,注射青霉素 |
| A. | 荧光蛋白是一种高分子化合物且能发生水解 | |
| B. | 用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 | |
| C. | 利用次氯酸钠溶液的碱性对餐具和环境消毒 | |
| D. | 大量排放PM2.5、SO2、NOX等会形成雾霾 |
(2)维生素C又称为抗坏血酸,在人体内有重要的功能.例如帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+.这说明维生素C具有还原性(填氧化性或还原性).
(3)写出下列空格内物质的名称、俗名或化学式:
| 名称 | 氧化铁 | 碳酸钠 | 碳酸氢钠 |
| 俗名 | 铁红 | 小苏打 | |
| 化学式 | Na2CO3 | NaHCO3 |
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 常温下,46 g分子式为C2H6O的物质中一定含有极性键为7NA,非极性键为NA | |
| C. | 125 mL 16 mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA | |
| D. | 标准状况下,体积为22.4 L NO2、N2O4的混合气体,升温至常温,则混合气体分子数为NA |
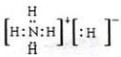 .
. ,很多不饱和有机物在E催化下可与H2加成反应:
,很多不饱和有机物在E催化下可与H2加成反应:
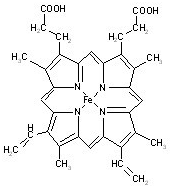 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.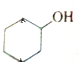 )中有3个手性碳原子.
)中有3个手性碳原子.