题目内容
14.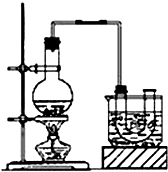 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:
①如图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小火加热,使其充分反应.
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为
Br2.
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是水浴加热.
(3)反应结束后,U形管中粗制的溴乙烷呈棕黄色.将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取下层(填“上层”或“下层”)液体.为了除去其中的杂质,可选择下列试剂中的A(填序号).
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
(4)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行蒸馏(填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后④①⑤③②(填序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却.
分析 (1)浓硫酸具有强的氧化性,温度高时能够氧化生成溴离子生成单质溴,溴单质挥发产生红棕色气体;
(2)溴乙烷沸点为38.4℃,同时考虑到浓硫酸的强氧化性,为避免更多的副反应进行,只要控制温度略高于38.4℃即行,结合水浴加热优点:受热均匀、便于控制温度解答;
(3)反应后为溴乙烷和水的混合物,二者互不相溶,溴乙烷密度大于水,分液后,溴乙烷中混有溴,除杂时注意溴和溴乙烷的性质角度考虑;
(4)依据溴乙烷沸点低的物理性质,可以利用蒸馏法提纯溴乙烷;
(5)检验氯代烃中的卤素原子:先将卤素原子变为卤素离子,再根据其卤化银沉淀的颜色来检验.
解答 解:(1)由于浓硫酸具有强氧化性,能氧化Br-会有溴单质生成,化学为Br2,溴单质挥发产生红棕色气体;
故答案为:Br2;
(2)为了更好的控制反应温度,除用图示的小火加热,可以用水浴加热,因为水浴加热受热均匀、便于控制温度;
故答案为:水浴加热;
(3)溴乙烷与水互不相溶,由于溴乙烷密度大于水的密度,故溴乙烷应该在下层;粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,
A.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故A正确;
B.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,故B错误;
C.氢氧化钠溶液显示碱性,可以除去杂质溴,但溴乙烷也会在此溶液里发生水解反应,故C错误;
D.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故D错误;
故答案为:下层;A;
(4)溴乙烷的沸点是38.4℃,故采用蒸馏操作分离提纯溴乙烷,
故答案为:蒸馏;
(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化中和过量的氢氧化钠,最后加入硝酸银,观察是否有黄色沉淀生成,所以正确的顺序为:④①⑤③②;
故答案为:④①⑤③②.
点评 本题以溴乙烷的制取为载体,考查了溴乙烷的制备、分离提纯,卤代烃中卤原子检验方法,考查学生对知识梳理和分析能力,注意知识的积累是解题的关键,难度不大.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案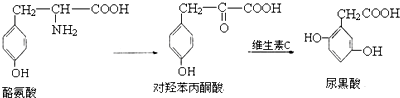
下列说法错误的是( )
| A. | 1mol酪氨酸能与含1molHCl的盐酸反应,又能与含2molNaOH的溶液反应 | |
| B. | 酪氨酸能发生加成、取代、消去和缩聚反应 | |
| C. | 1mol对羟苯丙酮酸最多可与5molH2反应 | |
| D. | 1mol尿黑酸最多可与3molBr2反应 |
(2)维生素C又称为抗坏血酸,在人体内有重要的功能.例如帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+.这说明维生素C具有还原性(填氧化性或还原性).
(3)写出下列空格内物质的名称、俗名或化学式:
| 名称 | 氧化铁 | 碳酸钠 | 碳酸氢钠 |
| 俗名 | 铁红 | 小苏打 | |
| 化学式 | Na2CO3 | NaHCO3 |
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 常温下,46 g分子式为C2H6O的物质中一定含有极性键为7NA,非极性键为NA | |
| C. | 125 mL 16 mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA | |
| D. | 标准状况下,体积为22.4 L NO2、N2O4的混合气体,升温至常温,则混合气体分子数为NA |
| A. | “膏液”的主要成分是石油 | B. | “膏液”是天然高分子化合物 | ||
| C. | “膏液”是烃的混合物 | D. | “膏液”能发生取代反应 |
 ,很多不饱和有机物在E催化下可与H2加成反应:
,很多不饱和有机物在E催化下可与H2加成反应:

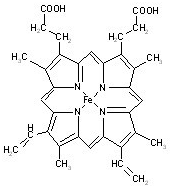 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.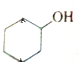 )中有3个手性碳原子.
)中有3个手性碳原子. 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是