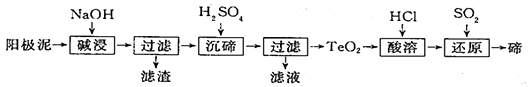
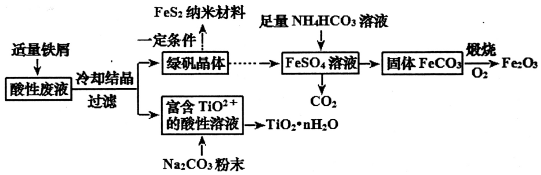
题目内容
20.下列实验或生产能达到目的是( )| A. | 电解熔融的AlCl3生产铝单质 | |
| B. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| C. | 用Ba(OH)2溶液可鉴别NaCl、AlCl3、NH4Cl、Na2SO4四种溶液 | |
| D. | 用分液漏斗从食醋中分离出乙酸 |
分析 A.氯化铝为共价化合物,不导电;
B.食盐水可吸收HCl,抑制氯气的溶解;
C.NaCl、AlCl3、NH4Cl、Na2SO4四种溶液分别与Ba(OH)2溶液反应的现象为:无现象、先生成白色沉淀后溶解、刺激性气体、白色沉淀;
D.食醋为溶液,不存在不溶性固体.
解答 解:A.氯化铝为共价化合物,不导电,应电解熔融氧化铝冶炼Al,故A错误;
B.食盐水可吸收HCl,抑制氯气的溶解,干燥后才得到纯净的Cl2,故B错误;
C.NaCl、AlCl3、NH4Cl、Na2SO4四种溶液分别与Ba(OH)2溶液反应的现象为:无现象、先生成白色沉淀后溶解、刺激性气体、白色沉淀,现象不同,可鉴别,故C正确;
D.食醋为溶液,不存在不溶性固体,应选蒸馏法从食醋中分离出乙酸,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握金属的冶炼、物质的检验、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.某温度时下列气体与过量的氧气混合共7L,充分燃烧后通过浓硫酸恢复原条件,气体体积变为4L,则原气体不可能为( )
| A. | C4H6 | B. | C3H8 | C. | C2H4 | D. | CH4 |
8.如表所示的四种短周期元素W、X、Y、Z,这四种元素的原子最外层电子数之和为22.下列说法错误的是( )
| X | |||
| W | Y | Z |
| A. | X、Y和氢三种元素形成的化合物中可能既有离子键、又有共价键 | |
| B. | Y的氧化物的通入过量BaCl2溶液中一定会产生白色沉淀 | |
| C. | W元素的单质是良好的半导体材料,它与Z元素可形成化合物WZ4 | |
| D. | 物质W3X4中,每个原子最外层均达到8电子稳定结构 |
15.下列可用于鉴别以下两种化合物的试剂是( )
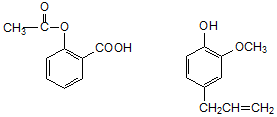

| A. | 银氨溶液 | B. | 稀溴水 | C. | 氯化铁溶液 | D. | 氢氧化钠溶液 |
12.下列事实与盐类水解无关的是( )
| A. | 氯化铝溶液蒸干后灼烧得不到无水氯化铝 | |
| B. | 氯化铁溶液常用作制印刷电路板的腐蚀剂 | |
| C. | 常用热的纯碱溶液除去油污 | |
| D. | 长期施用硫酸铵易使土壤酸化 |
 ;
; ;
;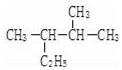 的名称(系统命名法)2,3-二甲基戊烷.
的名称(系统命名法)2,3-二甲基戊烷.