题目内容
8.如表所示的四种短周期元素W、X、Y、Z,这四种元素的原子最外层电子数之和为22.下列说法错误的是( )| X | |||
| W | Y | Z |
| A. | X、Y和氢三种元素形成的化合物中可能既有离子键、又有共价键 | |
| B. | Y的氧化物的通入过量BaCl2溶液中一定会产生白色沉淀 | |
| C. | W元素的单质是良好的半导体材料,它与Z元素可形成化合物WZ4 | |
| D. | 物质W3X4中,每个原子最外层均达到8电子稳定结构 |
分析 如表所示的四种短周期元素W、X、Y、Z,这四种元素的原子最外层电子数之和为22,由元素在周期表中位置可知,X处于第二周期,W、Y、Z处于第三周期,设W的最外层电子数为x,则X、Y、Z最外层电子数分别为x+1、x+2、x+3,则x+x+1+x+2+x+3=22,解得:x=4,故W为Si、X为N、Y为S、Z为Cl,据此结合元素周期律知识解答.
解答 解:如表所示的四种短周期元素W、X、Y、Z,这四种元素的原子最外层电子数之和为22,由元素在周期表中位置可知,X处于第二周期,W、Y、Z处于第三周期,设W的最外层电子数为x,则X、Y、Z最外层电子数分别为x+1、x+2、x+3,则x+x+1+x+2+x+3=22,解得:x=4,故W为Si、X为N、Y为S、Z为Cl,
A.X为N、Y为S,N、S和氢三种元素形成的化合物硫化铵中可能既有离子键、又有共价键,故A正确;
B.Y为S,其氧化物有二氧化硫和三氧化硫,二氧化硫通入过量BaCl2溶液中不会出现沉淀,故B错误;
C.W元素的单质为Si,Si单质是良好的半导体材料,Si它与Cl元素可形成化合物SiCl4,故C正确;
D.W3X4为Si3N4,该化合物中Si、N原子的最外层均达到8电子稳定结构,故D正确;
故选B.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握常见元素及其化合物性质,明确原子结构与元素周期律、元素周期表的关系.

练习册系列答案
相关题目
19.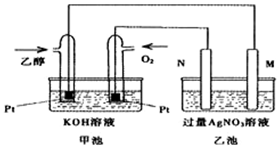 已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:
已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:
(1)图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是C.
A.M电极的材料是石墨
B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448mL
C.在此过程中,甲池中OH-向通乙醇的一极移动
D.在此过程中,乙池溶液中电子从M电极向N电极移动
(2)写出乙醇燃料电池正极的电极反应式O2+2H2O+4e-=4OH-.
(3)已知:甲醇脱水反应 ①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1
甲醇制烯烃反应 ②2CH3OH(g)=C2H4 (g)+2H2O(g)?△H2
乙醇异构化反应 ③CH3CH2OH(g)=CH3OCH3(g))?△H3
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H=△H1-△H2-△H3(用含△H1、△H2、△H3表示).
(4)工业上可利用CO或CO2来生产甲醇.甲醇制备的相关信息如表:
①据表信息推导出K1、K2与K3之间的关系,K3=K1K2用K1、K2表示).
②反应②是吸热反应(选填“吸热”“放热”).
 已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:
已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:(1)图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是C.
A.M电极的材料是石墨
B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448mL
C.在此过程中,甲池中OH-向通乙醇的一极移动
D.在此过程中,乙池溶液中电子从M电极向N电极移动
(2)写出乙醇燃料电池正极的电极反应式O2+2H2O+4e-=4OH-.
(3)已知:甲醇脱水反应 ①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1
甲醇制烯烃反应 ②2CH3OH(g)=C2H4 (g)+2H2O(g)?△H2
乙醇异构化反应 ③CH3CH2OH(g)=CH3OCH3(g))?△H3
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H=△H1-△H2-△H3(用含△H1、△H2、△H3表示).
(4)工业上可利用CO或CO2来生产甲醇.甲醇制备的相关信息如表:
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
②反应②是吸热反应(选填“吸热”“放热”).
16. 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q; r、t、u是这些元素组成的二元化合物,其中u为葡萄酒中抑菌成分;25℃时,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q; r、t、u是这些元素组成的二元化合物,其中u为葡萄酒中抑菌成分;25℃时,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q; r、t、u是这些元素组成的二元化合物,其中u为葡萄酒中抑菌成分;25℃时,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q; r、t、u是这些元素组成的二元化合物,其中u为葡萄酒中抑菌成分;25℃时,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:X<Y<Z<W | |
| B. | 元素的非金属性:Y>W>X | |
| C. | t中只含离子键 | |
| D. | v能抑制水的电离而u能促进水的电离 |
13. 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )| A. | W、与X、Y、Z形成的化合物均是共价化合物 | |
| B. | 简单离子半径:Z>Y>X | |
| C. | X、Y、Z形成的化合物水溶液一定呈碱性 | |
| D. | X、Y形成的化合物一定含有离子键 |
20.下列实验或生产能达到目的是( )
| A. | 电解熔融的AlCl3生产铝单质 | |
| B. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| C. | 用Ba(OH)2溶液可鉴别NaCl、AlCl3、NH4Cl、Na2SO4四种溶液 | |
| D. | 用分液漏斗从食醋中分离出乙酸 |
17.下列离子在溶液中能大量共存的是( )
| A. | H+、AlO2-、CO32- | B. | K+、Ba2+、SO42- | C. | NH4+、OH-、NO3- | D. | Fe3+、NO3-、Cl- |
8.某固体可能含有Na+、NH4+、Fe3+、Fe2+、Cl-、I-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水,加入足量BaCl2溶液,得沉淀4.46g
(2)另一份固体溶于水,与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况),并得到沉淀,沉淀经洗涤、灼烧,最终获得1.6g红色固体.下列说法正确的是( )
(1)一份固体溶于水,加入足量BaCl2溶液,得沉淀4.46g
(2)另一份固体溶于水,与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况),并得到沉淀,沉淀经洗涤、灼烧,最终获得1.6g红色固体.下列说法正确的是( )
| A. | 该固体中一定含有NH4+、Cl-、SO42-、Na+ | |
| B. | 根据以上实验,无法确定该固体中有Cl- | |
| C. | 该固体中只含有NH4+、Fe3+、SO42-、Cl- | |
| D. | 该固体中一定没有I-、CO32- |