题目内容
11.某温度时下列气体与过量的氧气混合共7L,充分燃烧后通过浓硫酸恢复原条件,气体体积变为4L,则原气体不可能为( )| A. | C4H6 | B. | C3H8 | C. | C2H4 | D. | CH4 |
分析 设气体的分子式为CxHy,与氧气反应的化学方程式为CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,浓硫酸吸收水蒸气,恢复到原来条件,气体体积变为4L,相同条件下气体的体积之比等于其物质的量之比,设实际参加反应烃和氧气的体积为V,则 V<7L,结合各选项讨论,据此分析解答.
解答 解:设气体的分子式为CxHy,与氧气反应的化学方程式为:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,通过浓硫酸后,恢复到原来的温度,气体的总体积缩小了7-4=3L,则
设实际参加反应烃和氧气的体积为V,则
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O△V减少
1 x+$\frac{y}{4}$ x $\frac{y}{2}$ 1+$\frac{y}{4}$
V 7-4
则 (1+x+$\frac{y}{4}$ ):(1+$\frac{y}{4}$)=V:3,
V<7L,
A.C4H6,x=4,y=6,V=$\frac{39}{5}$>7L,不可能,符合题意,故A选;
B.C3H8,x=3,y=8,V=6<7L,可能,不符合题意,故B不选;
C.C2H4,x=2,y=4,V=6<7L,可能,不符合题意,故C不选;
D.CH4,x=1,y=4,V=4.5<7L,可能,不符合题意,故D不选;
故选A.
点评 本题考查了有机物分子式的确定,侧重于学生的分析、计算能力的考查,题目难度中等,明确差量法在化学计算中的应用为解答根据,要求学生能够正确书写常见烃的燃烧通式.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案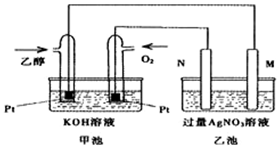 已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:
已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:(1)图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是C.
A.M电极的材料是石墨
B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448mL
C.在此过程中,甲池中OH-向通乙醇的一极移动
D.在此过程中,乙池溶液中电子从M电极向N电极移动
(2)写出乙醇燃料电池正极的电极反应式O2+2H2O+4e-=4OH-.
(3)已知:甲醇脱水反应 ①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1
甲醇制烯烃反应 ②2CH3OH(g)=C2H4 (g)+2H2O(g)?△H2
乙醇异构化反应 ③CH3CH2OH(g)=CH3OCH3(g))?△H3
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H=△H1-△H2-△H3(用含△H1、△H2、△H3表示).
(4)工业上可利用CO或CO2来生产甲醇.甲醇制备的相关信息如表:
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
②反应②是吸热反应(选填“吸热”“放热”).
 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q; r、t、u是这些元素组成的二元化合物,其中u为葡萄酒中抑菌成分;25℃时,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q; r、t、u是这些元素组成的二元化合物,其中u为葡萄酒中抑菌成分;25℃时,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:X<Y<Z<W | |
| B. | 元素的非金属性:Y>W>X | |
| C. | t中只含离子键 | |
| D. | v能抑制水的电离而u能促进水的电离 |
| A. | 电解熔融的AlCl3生产铝单质 | |
| B. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| C. | 用Ba(OH)2溶液可鉴别NaCl、AlCl3、NH4Cl、Na2SO4四种溶液 | |
| D. | 用分液漏斗从食醋中分离出乙酸 |
| A. | 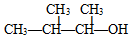 的命名为:3-甲基-2-丁醇 的命名为:3-甲基-2-丁醇 | |
| B. | 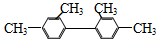 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| C. | 羟基的电子式是 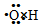 | |
| D. | 软脂酸和油酸互为同系物 |
 ,其核磁共振氢谱中有2个信号(参见图1).
,其核磁共振氢谱中有2个信号(参见图1).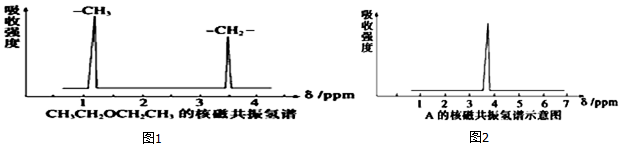
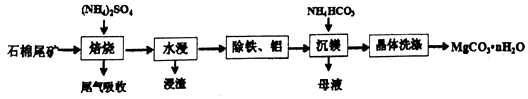
 .
.