题目内容
氧化还原反应中除了原子守恒(质量守恒)外,氧化剂得电子总数和还原剂失电子总数相等,在一定条件下,RO3n-和I-发生反应的离子方程式为:RO3n-+6I-+6H+=R-+3I2+3H2O(R为主族元素),则:RO3n-中R的化合价为 价,n值为 .
考点:氧化还原反应
专题:
分析:RO3n-+6I-+6H+=R-+3I2+3H2O中,由电荷守恒可知n,RO3n-中正负化合价的代数和为-n,以此来解答.
解答:
解:RO3n-+6I-+6H+=R-+3I2+3H2O中,由电荷守恒可知-n+(-6)+(+6)=-1,解得n=1,
RO3-中正负化合价的代数和为-1,则R元素的化合价为-1-(-2)×3=+5,
故答案为:+5;1.
RO3-中正负化合价的代数和为-1,则R元素的化合价为-1-(-2)×3=+5,
故答案为:+5;1.
点评:本题考查氧化还原反应,为高频考点,把握电荷守恒及化合价计算原则为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
下列关于SO3的描述中不正确的是( )
| A、在一定条件下能分解为SO2和O2 |
| B、是硫酸的酸酐 |
| C、其中硫元素已不能再被氧化 |
| D、取8g SO3溶于92g水中得8%溶液 |
钛(Ti)被称为继铁、铝之后的第三金属,以TiO2制取Ti的主要反应有:
①TiO2+2C+2Cl2
TiCl4+2CO,②TiCl4+2Mg
2MgCl2+Ti;下列叙述正确的是( )
①TiO2+2C+2Cl2
| ||
| ||
| A、反应①是复分解反应 |
| B、反应②是置换反应 |
| C、反应①中TiO2是氧化剂 |
| D、反应②中金属镁是氧化剂 |
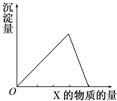 把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入(或通入)的X物质的量的关系如图所示,符合图中曲线的是( )
把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入(或通入)的X物质的量的关系如图所示,符合图中曲线的是( )| A、X为CO2,Y为Ca(OH)2 |
| B、X为NH3?H2O,Y为AlCl3 |
| C、X为NaOH,Y为AlCl3 |
| D、X为HCl,Y为Na[Al(OH)4] |

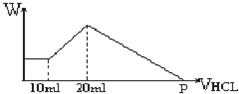 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示: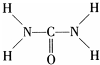 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.