题目内容
已知尿素的结构式为: 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
(1)C、N、O三种元素的第一电离能由大到小的顺序是 ;电负性由大到小顺序是 .
(2)尿素分子中C和N原子的杂化方式分别是 、 .
(3)NH4+中H-N-H键角比NH3中H-N-H键角大,原因为 .
(4)美国科学家合成了结构呈“V”形的N5+,已知该离子中各原子均达到8电子稳定结构.则有关该离子的下列说法中正确的是 .
A.每个N5+中含有35个质子和36个电子
B.该离子中有非极性键和配位键
C.该离子中含有2个π键
D.与PCl4+互为等电子体
(5)[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(Ⅲ)之间的作用力是 .
FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是 .
KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是 .
 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.(1)C、N、O三种元素的第一电离能由大到小的顺序是
(2)尿素分子中C和N原子的杂化方式分别是
(3)NH4+中H-N-H键角比NH3中H-N-H键角大,原因为
(4)美国科学家合成了结构呈“V”形的N5+,已知该离子中各原子均达到8电子稳定结构.则有关该离子的下列说法中正确的是
A.每个N5+中含有35个质子和36个电子
B.该离子中有非极性键和配位键
C.该离子中含有2个π键
D.与PCl4+互为等电子体
(5)[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(Ⅲ)之间的作用力是
FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是
KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是
考点:配合物的成键情况,元素电离能、电负性的含义及应用,键能、键长、键角及其应用,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;同一周期元素的电负性随着原子序数的增大而呈增强;
(2)由尿素的结构式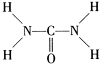 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
(3)排斥力:孤对电子-成键电子>成键电子-成键电子,排斥力大,键角被压缩;
(4)A.N5+是由N5分子失去1个电子得到的,1个N5分子是由5个氮原子构成的,据此进行分析解答.
B.同种非金属元素之间形成非极性共价键,不同种非金属元素之间形成极性共价键,含有孤电子对和含有空轨道的原子之间能形成配位键,配位键属于共价键;
C.1个氮氮三键中含有2个π键;
D.根据具有相同原子数和价电子数的微粒互称为等电子体;
(5)Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,二者形成配位键;根据化学式中化合价的代数和为零来书写化学式;氧与硫的最外层电子数相同,先确定SCN-中各原子的连接顺序以及成键方式,再结合离子电子式的书写方法书写.
(2)由尿素的结构式
 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;(3)排斥力:孤对电子-成键电子>成键电子-成键电子,排斥力大,键角被压缩;
(4)A.N5+是由N5分子失去1个电子得到的,1个N5分子是由5个氮原子构成的,据此进行分析解答.
B.同种非金属元素之间形成非极性共价键,不同种非金属元素之间形成极性共价键,含有孤电子对和含有空轨道的原子之间能形成配位键,配位键属于共价键;
C.1个氮氮三键中含有2个π键;
D.根据具有相同原子数和价电子数的微粒互称为等电子体;
(5)Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,二者形成配位键;根据化学式中化合价的代数和为零来书写化学式;氧与硫的最外层电子数相同,先确定SCN-中各原子的连接顺序以及成键方式,再结合离子电子式的书写方法书写.
解答:
解:(1)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序为:N>O>C;同一周期元素的电负性随着原子序数的增大而呈增强,所以电负性由大到小的顺序为:O>N>C,
故答案为:N>O>C;O>N>C;
(2)由尿素分子的结构式 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,
故答案为:sp2;sp3;
(3)NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小,故NH+4中H-N-H键角大,
故答案为:NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小;
(4)A.1个氮原子中含有7个质子、7个电子,则1个N5分子中含有35个质子、35个电子,N5+是由N5分子失去1个电子得到的,则1个N5+粒子中有35个质子,34个电子,故A错误;
B.N5+中氮氮三键是非极性共价键,中心的氮原子有空轨道,两边的两个氮原子提供孤电子对形成配位键,故B正确;
C.1个氮氮三键中含有2个π键,所以该离子中含有4个π键,故C错误;
D.N5+和PCl4+具有相同原子数,但价电子数分别为24,27,不是等电子体,故D错误;
故答案为:B;
(5)Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,二者形成配位键;FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是K2Fe(SCN)5;SCN-中各原子的连接顺序为S-C-N,S与C形成一对共用电子对,C与N形成三对共用电子对,SCN-得到的一个电子给了S,故SCN-的电子式 ,故答案为:配位键;K2Fe(SCN)5;
,故答案为:配位键;K2Fe(SCN)5; .
.
故答案为:N>O>C;O>N>C;
(2)由尿素分子的结构式
 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2;sp3;
(3)NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小,故NH+4中H-N-H键角大,
故答案为:NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小;
(4)A.1个氮原子中含有7个质子、7个电子,则1个N5分子中含有35个质子、35个电子,N5+是由N5分子失去1个电子得到的,则1个N5+粒子中有35个质子,34个电子,故A错误;
B.N5+中氮氮三键是非极性共价键,中心的氮原子有空轨道,两边的两个氮原子提供孤电子对形成配位键,故B正确;
C.1个氮氮三键中含有2个π键,所以该离子中含有4个π键,故C错误;
D.N5+和PCl4+具有相同原子数,但价电子数分别为24,27,不是等电子体,故D错误;
故答案为:B;
(5)Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,二者形成配位键;FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是K2Fe(SCN)5;SCN-中各原子的连接顺序为S-C-N,S与C形成一对共用电子对,C与N形成三对共用电子对,SCN-得到的一个电子给了S,故SCN-的电子式
 ,故答案为:配位键;K2Fe(SCN)5;
,故答案为:配位键;K2Fe(SCN)5; .
.
点评:本题考查了第一电离能和电负性的比较、杂化轨道理论、配合物、晶胞计算、电子式等,题目涉及的知识点较多,综合性较强,题目难度中等.

练习册系列答案
相关题目
由MgO、Al2O3、SiO2、Fe2O3组成的混合粉末.现取一份该混合粉末试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
| A、从组成看,其成分皆是碱性氧化物 |
| B、溶液Y中的阳离子主要是Mg2+、Al3+、Fe2+、H+ |
| C、沉淀X的成分是SiO2 |
| D、在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2 |
既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
| A、①②③ | B、②③ |
| C、②④ | D、①②③④ |
在中和热测定的实验中不需要用到的仪器是( )
| A、量筒 | B、温度计 |
| C、托盘天平 | D、环形玻璃搅拌棒 |
某有机物可被氧化为甲、也可被还原为乙,甲和乙都能跟钠反应放出氢气,且甲、乙在浓硫酸催化下反应生成丙,丙能发生银镜反应,丙的结构简式是( )
| A、CH3COOCH3 |
| B、HCOOCH3 |
| C、HCOOCH2CH3 |
| D、HCOOCH2CH2CH3 |
下列实验仪器不能直接用于加热的是( )
| A、试管 | B、坩埚 | C、蒸发皿 | D、量筒 |
下列说法中可以充分说明反应P(g)+Q(g)?R(g)+S(g)在恒温下已达平衡状态的是( )
| A、反应容器内压强不随时间变化 |
| B、P和S的生成速率相等 |
| C、反应容器内P、Q、R、S四者共存 |
| D、反应容器内总物质的量不随时间而变化 |