题目内容
铜在自然界存在的矿物很多,人类最早利用的合金就是铜合金
(1)火法炼铜的主要反应:
①2CuFeS2+4O2
Cu2S+3SO2+2FeO(炉渣)
②2Cu2S+3O2
2Cu2O+3SO2
③2Cu2O+Cu2S
6Cu+SO2↑
(2)选用提供的试剂,设计实验验证炉渣中含有FeO(同时可能含有Fe2O3),提供的试剂:稀盐酸,稀硫酸,KSCN溶液,KMnO4溶液.NaOH溶液,K2[Fe(CN)4],碘水,证明炉渣中含有FeO的实验操作及现象为 .
(3)现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

则反应Ⅰ的化学方程式为 ,与火法炼铜相比,该法的优点有 、 (回答两点即可
(4)在以上方法当中,某些因素都对通的浸出率有较大影响,下面是实验得出的几种因素对铜的浸出率影响的变化曲线图.
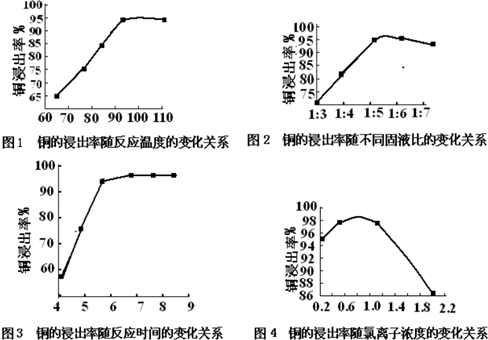
请分析上表,得出最佳工艺条件为 (填序号)
(5)在得到的硫酸铜溶液获得CuSO4?5H2O,需要经过加热蒸发, ,过滤等操作,除烧杯,漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 .
(1)火法炼铜的主要反应:
①2CuFeS2+4O2
| ||
②2Cu2S+3O2
| ||
③2Cu2O+Cu2S
| ||
(2)选用提供的试剂,设计实验验证炉渣中含有FeO(同时可能含有Fe2O3),提供的试剂:稀盐酸,稀硫酸,KSCN溶液,KMnO4溶液.NaOH溶液,K2[Fe(CN)4],碘水,证明炉渣中含有FeO的实验操作及现象为
(3)现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

则反应Ⅰ的化学方程式为
(4)在以上方法当中,某些因素都对通的浸出率有较大影响,下面是实验得出的几种因素对铜的浸出率影响的变化曲线图.

| 选项 | 反应温度/℃ | 固液比 | c(Cl-)/mol?L-1 | 反应时间/h |
| a | 100 | 1:5.5 | 0.7 | 7 |
| b | 95 | 1:5 | 0.8 | 6 |
| c | 110 | 1:6 | 0.9 | 8 |
(5)在得到的硫酸铜溶液获得CuSO4?5H2O,需要经过加热蒸发,
考点:铜金属及其重要化合物的主要性质
专题:实验设计题,几种重要的金属及其化合物
分析:(2)若Fe2O3中含有FeO,利用稀酸(非氧化性)溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO4溶液具有强氧化性,可利用KMnO4溶液褪色来证明;
(3)依据流程转化可知,反应Ⅰ是硫化铜和氧气、硫酸发生氧化还原反应生成硫酸铜、硫和水,火法炼钢中产生有毒的二氧化硫,而湿法炼铜中不产生有毒气体,故其污染性小、环保,同时湿法炼铜还得到副产品硫酸亚铁晶体及其硫磺,充分利用了资源;
(4)依据图象分析曲线变化特征和变化过程,图标数据分析判断反应所需的条件;
(5)CuSO4?5H2O受热易失水,故从溶液中得到晶体的操作应是蒸发浓缩冷却结晶过滤洗涤,又因为该晶体乙溶于水故不能用水洗涤,需要用乙醇洗涤,不仅洗涤晶体表面的水和杂质,还可以减少晶体损失.
(3)依据流程转化可知,反应Ⅰ是硫化铜和氧气、硫酸发生氧化还原反应生成硫酸铜、硫和水,火法炼钢中产生有毒的二氧化硫,而湿法炼铜中不产生有毒气体,故其污染性小、环保,同时湿法炼铜还得到副产品硫酸亚铁晶体及其硫磺,充分利用了资源;
(4)依据图象分析曲线变化特征和变化过程,图标数据分析判断反应所需的条件;
(5)CuSO4?5H2O受热易失水,故从溶液中得到晶体的操作应是蒸发浓缩冷却结晶过滤洗涤,又因为该晶体乙溶于水故不能用水洗涤,需要用乙醇洗涤,不仅洗涤晶体表面的水和杂质,还可以减少晶体损失.
解答:
解:(2)若Fe2O3中含有FeO,利用稀酸(非氧化性)溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO4溶液具有强氧化性,可使KMnO4溶液褪色,
则选择试剂为稀硫酸、KMnO4溶液,操作为取少量固体溶于稀硫酸,然后滴加KMnO4溶液,观察到溶液使KMnO4溶液褪色,则证明含有FeO,
故答案为:取少量固体溶于稀硫酸,然后滴加KMnO4溶液,观察到溶液使KMnO4溶液褪色,则证明含有FeO;
(3)依据流程转化可知,反应Ⅰ是硫化铜和氧气、硫酸发生氧化还原反应生成硫酸铜、硫和水,反应的化学方程式为:2CuS+O2+H2SO4=2CuSO4+2S+2H2O,火法炼钢中产生有毒的二氧化硫,而湿法炼铜中不产生有毒气体,故其污染性小、环保,同时湿法炼铜还得到副产品硫酸亚铁晶体及其硫磺,充分利用了资源;
故答案为:2CuS+O2+H2SO4=2CuSO4+2S+2H2O,原料利用率高,不产生二氧化硫等污染气体、能耗低;
(4)从图1可以看出,铜的浸出率随反应温度升高二增大,在为的达到95°C后,铜的浸出率随温度的变化不明显,但温度过高能耗增加,由此可知适应的反应温度为95°C,图3可以看出:固液比大于1:5时,铜的浸出率随固液比的增大而有所减小;固液比小于1:5时铜的浸出率随固液比的减小而有所下降,因此适宜的固液比为1:5;从图4可以看出铜的浸出率随反应时间增大而增大,但在反应时间超出6h后,随反应时间的延长铜的浸出率增大的很缓慢,同时反应时间过长,即增加能耗,有降低设备利用率,故适宜的反应时间6h;表中数据变化分析,加入氯离子能改变铜的浸出效果,但氯离子浓度超过0.8mol/L,时铜的浸出率随氯离子浓度增加反而减小,故适宜的氯离子浓度维持在0.8mol/L;
故答案为:b;
(4)CuSO4?5H2O受热易失水,故从溶液中得到晶体的操作应是蒸发浓缩冷却结晶过滤洗涤,又因为该晶体乙溶于水故不能用水洗涤,需要用乙醇洗涤,不仅洗涤晶体表面的水和杂质,还可以减少晶体损失,过滤等操作,除烧杯,漏斗外,过滤操作还用到另一玻璃仪器为玻璃棒,该仪器在此操作中的主要作用是引流;
故答案为:冷却结晶,引流.
则选择试剂为稀硫酸、KMnO4溶液,操作为取少量固体溶于稀硫酸,然后滴加KMnO4溶液,观察到溶液使KMnO4溶液褪色,则证明含有FeO,
故答案为:取少量固体溶于稀硫酸,然后滴加KMnO4溶液,观察到溶液使KMnO4溶液褪色,则证明含有FeO;
(3)依据流程转化可知,反应Ⅰ是硫化铜和氧气、硫酸发生氧化还原反应生成硫酸铜、硫和水,反应的化学方程式为:2CuS+O2+H2SO4=2CuSO4+2S+2H2O,火法炼钢中产生有毒的二氧化硫,而湿法炼铜中不产生有毒气体,故其污染性小、环保,同时湿法炼铜还得到副产品硫酸亚铁晶体及其硫磺,充分利用了资源;
故答案为:2CuS+O2+H2SO4=2CuSO4+2S+2H2O,原料利用率高,不产生二氧化硫等污染气体、能耗低;
(4)从图1可以看出,铜的浸出率随反应温度升高二增大,在为的达到95°C后,铜的浸出率随温度的变化不明显,但温度过高能耗增加,由此可知适应的反应温度为95°C,图3可以看出:固液比大于1:5时,铜的浸出率随固液比的增大而有所减小;固液比小于1:5时铜的浸出率随固液比的减小而有所下降,因此适宜的固液比为1:5;从图4可以看出铜的浸出率随反应时间增大而增大,但在反应时间超出6h后,随反应时间的延长铜的浸出率增大的很缓慢,同时反应时间过长,即增加能耗,有降低设备利用率,故适宜的反应时间6h;表中数据变化分析,加入氯离子能改变铜的浸出效果,但氯离子浓度超过0.8mol/L,时铜的浸出率随氯离子浓度增加反而减小,故适宜的氯离子浓度维持在0.8mol/L;
故答案为:b;
(4)CuSO4?5H2O受热易失水,故从溶液中得到晶体的操作应是蒸发浓缩冷却结晶过滤洗涤,又因为该晶体乙溶于水故不能用水洗涤,需要用乙醇洗涤,不仅洗涤晶体表面的水和杂质,还可以减少晶体损失,过滤等操作,除烧杯,漏斗外,过滤操作还用到另一玻璃仪器为玻璃棒,该仪器在此操作中的主要作用是引流;
故答案为:冷却结晶,引流.
点评:本题考查了流程分析判断铜及其化合物性质的分析判断,图象分析应用,掌握基础是关键,题目难度较大.

练习册系列答案
相关题目
将过量的CO2通入下列溶液中,最终不会出现浑浊的是( )
| A、CaCl2溶液 |
| B、NaAlO2溶液 |
| C、饱和Na2CO3溶液 |
| D、水玻璃 |
如图实验操作装置正确的是( )
A、 CaCO3的过滤 |
B、 向NaCl溶液中滴加AgNO3溶液 |
C、 硫酸铜晶体的称量 |
D、 除去水CO中的CO2气体 |
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、K2SiO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:
根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A、溶液甲中一定含有K2SiO3、NaNO2 |
| B、无法判断溶液中是否有K2SO3 |
| C、气体A和气体B-定为混合物 |
| D、原混合物中一定有Fe2O3 |
由MgO、Al2O3、SiO2、Fe2O3组成的混合粉末.现取一份该混合粉末试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
| A、从组成看,其成分皆是碱性氧化物 |
| B、溶液Y中的阳离子主要是Mg2+、Al3+、Fe2+、H+ |
| C、沉淀X的成分是SiO2 |
| D、在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2 |