题目内容
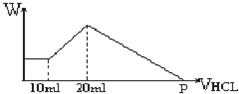 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:(1)混合物中NaOH的物质的量为
(2)混合物中AlCl3质量为
(3)混合物中MgCl2质量为
(4)P点表示盐酸的体积是
考点:镁、铝的重要化合物,化学方程式的有关计算
专题:图示题
分析:(1-3)由生成沉淀的质量关系图可知,滴加的前10mL稀盐酸,没有影响沉淀的量,说明滴加的稀盐酸在与混合物中剩余的氢氧化钠发生反应;继续滴加稀盐酸时,沉淀量增加,此时稀盐酸与NaAlO2发生反应产生Al(OH)3沉淀;此后再滴加的稀盐酸与氢氧化铝和氢氧化镁的沉淀发生反应,直至Mg(OH)2和Al(OH)3沉淀全部溶解;综合以上分析,混合物中的氢氧化钠溶于水后与氯化镁、氯化铝发生反应后还有剩余,剩余的氢氧化钠与稀盐酸发生反应;固体物中的氯化铝与氢氧化钠反应生成NaAlO2;因此,计算出的质量就可以根据反应的化学方程式计算氯化铝的质量;
(4)P点为全部反应完全反应后所消耗稀盐酸的量,需要计算出氢氧化铝、氢氧化镁两种沉淀物完全溶解所消耗稀盐酸的量.
(4)P点为全部反应完全反应后所消耗稀盐酸的量,需要计算出氢氧化铝、氢氧化镁两种沉淀物完全溶解所消耗稀盐酸的量.
解答:
解:(1-3)从图中可以看出,Mg(OH)2的质量为0.58 g,即0.01 mol,根据反应:MgCl2+2NaOH═2NaCl+Mg(OH)2↓,
m(MgCl2)=0.01 mol×95 g?mol-1=0.95 g,n1(NaOH)=2n[Mg(OH)2]=0.02 mol.
开始至加入10 mL盐酸,发生反应:NaOH+HCl═NaCl+H2O,
n2(NaOH)=n(HCl)=0.5 mol?L-1×10×10-3L=5×10-3 mol.
盐酸的加入量从10~20 mL 发生反应:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
n(NaAlO2)=n(HCl)=0.5 mol?L-1×(20-10)×10-3L=0.005 mol.
根据反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
n3(NaOH)=4n(NaAlO2)=0.02 mol,
m(AlCl3)=0.005 mol×133.5 g?mol-1=0.67 g,
n(NaOH)=0.02 mol+5×10-3mol+0.02 mol=0.045mol.
故答案:(1)0.045mol;(2)0.67g;(3)0.95g;
(2)根据反应:Al(OH)3+3HCl═AlCl3+3H2O,
Mg(OH)2+2HCl═MgCl2+2H2O
n(HCl)=0.005 mol×3+0.01 mol×2=0.035 mol
V(HCl)=
=70mL
P点加入盐酸的体积为20mL+70mL=90mL.
答:P点所表示的盐酸的体积是90mL.
m(MgCl2)=0.01 mol×95 g?mol-1=0.95 g,n1(NaOH)=2n[Mg(OH)2]=0.02 mol.
开始至加入10 mL盐酸,发生反应:NaOH+HCl═NaCl+H2O,
n2(NaOH)=n(HCl)=0.5 mol?L-1×10×10-3L=5×10-3 mol.
盐酸的加入量从10~20 mL 发生反应:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
n(NaAlO2)=n(HCl)=0.5 mol?L-1×(20-10)×10-3L=0.005 mol.
根据反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
n3(NaOH)=4n(NaAlO2)=0.02 mol,
m(AlCl3)=0.005 mol×133.5 g?mol-1=0.67 g,
n(NaOH)=0.02 mol+5×10-3mol+0.02 mol=0.045mol.
故答案:(1)0.045mol;(2)0.67g;(3)0.95g;
(2)根据反应:Al(OH)3+3HCl═AlCl3+3H2O,
Mg(OH)2+2HCl═MgCl2+2H2O
n(HCl)=0.005 mol×3+0.01 mol×2=0.035 mol
V(HCl)=
| 0.035mol |
| 0.5mol/L |
P点加入盐酸的体积为20mL+70mL=90mL.
答:P点所表示的盐酸的体积是90mL.
点评:根据滴加稀盐酸与产生沉淀的关系图,分析各阶段所发生的反应,利用各阶段反应的化学方程式进行相关物质质量的计算;本题所涉及的反应比较复杂,在分析时逐个反应梳理清楚是解决本问题的关键.

练习册系列答案
相关题目
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、K2SiO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:
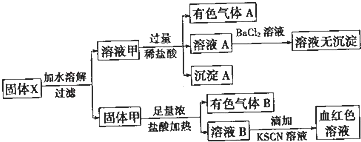
根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A、溶液甲中一定含有K2SiO3、NaNO2 |
| B、无法判断溶液中是否有K2SO3 |
| C、气体A和气体B-定为混合物 |
| D、原混合物中一定有Fe2O3 |
做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(H2C2O4乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+C2O42-+H+═CO2↑+Mn2++□
下列有关叙述不正确的是( )
下列有关叙述不正确的是( )
| A、该反应的氧化剂为KMnO4 |
| B、发生还原反应的是C2O42- |
| C、该离子方程式右侧方框内的产物是H2O |
| D、16mol H+参加反应时,电子转移10mol |
向下列溶液中滴加稀H2SO4,生成白色沉淀,继续滴加稀H2SO4,沉淀又溶解的是( )
| A、MgCl2溶液 |
| B、Na2SiO3溶液 |
| C、Cu(NO3)2溶液 |
| D、Na[Al(OH)4]溶液 |
既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
| A、①②③ | B、②③ |
| C、②④ | D、①②③④ |
在中和热测定的实验中不需要用到的仪器是( )
| A、量筒 | B、温度计 |
| C、托盘天平 | D、环形玻璃搅拌棒 |
 ②
② ③
③
 (1)指出提取碘的过程中有关的实验操作名称:①
(1)指出提取碘的过程中有关的实验操作名称:①