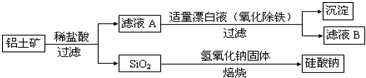
题目内容
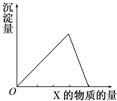 把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入(或通入)的X物质的量的关系如图所示,符合图中曲线的是( )
把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入(或通入)的X物质的量的关系如图所示,符合图中曲线的是( )| A、X为CO2,Y为Ca(OH)2 |
| B、X为NH3?H2O,Y为AlCl3 |
| C、X为NaOH,Y为AlCl3 |
| D、X为HCl,Y为Na[Al(OH)4] |
考点:镁、铝的重要化合物
专题:
分析:随着X的不断加入,反应开始沉淀逐渐增加,当达到最大量时,随着X的不断加入,反应生成沉淀逐渐减少直至为0,并且产生最大量的沉淀消耗X的量是将所有沉淀消耗完毕所消耗的量的3倍,其次将四个反应的化学反应原理逐一分析,分析沉淀的生成与X试剂的关系.最后和图象对比可解答.
解答:
解:随着X的不断加入,反应开始沉淀逐渐增加,当达到最大量时,随着X的不断加入,反应生成沉淀逐渐减少直至为0,并且产生最大量的沉淀消耗X的量是将所有沉淀消耗完毕所消耗的量的3倍.
A、氢氧化钙与二氧化碳反应生成的碳酸钙沉淀以及碳酸钙和二氧化碳继续反应将沉淀消耗完毕的两个过程中,消耗的二氧化碳量之比是1:1,所以不符合图象,故A错误.
B、氨水通入到AlCl3中,会产生白色沉淀,直到最大量,但是氢氧化铝不溶于氨水中,沉淀量不会减少,不符合图象,故B错误;
C、氯化铝和氢氧化钠反应,产生最大量的氢氧化铝沉淀消耗盐酸3mol,将所有的沉淀消耗完毕所消耗盐酸的量为1mol,前后量之比是3:1,符合图象,故C正确;
D、1molNa[Al(OH)4]中加盐酸时,产生最大量的氢氧化铝沉淀消耗盐酸1mol,将所有的沉淀消耗完毕所消耗盐酸的量为3mol,前后量之比是1:3,不是3:1,所以不符合图象,故D错误;
故选C.
A、氢氧化钙与二氧化碳反应生成的碳酸钙沉淀以及碳酸钙和二氧化碳继续反应将沉淀消耗完毕的两个过程中,消耗的二氧化碳量之比是1:1,所以不符合图象,故A错误.
B、氨水通入到AlCl3中,会产生白色沉淀,直到最大量,但是氢氧化铝不溶于氨水中,沉淀量不会减少,不符合图象,故B错误;
C、氯化铝和氢氧化钠反应,产生最大量的氢氧化铝沉淀消耗盐酸3mol,将所有的沉淀消耗完毕所消耗盐酸的量为1mol,前后量之比是3:1,符合图象,故C正确;
D、1molNa[Al(OH)4]中加盐酸时,产生最大量的氢氧化铝沉淀消耗盐酸1mol,将所有的沉淀消耗完毕所消耗盐酸的量为3mol,前后量之比是1:3,不是3:1,所以不符合图象,故D错误;
故选C.
点评:本题是图象和化学知识相结合的题型,涉及知识点较多.要求学生有将图象信息转换为化学信息的能力,同时对化学知识必须十分熟练,才可能快速解题.

练习册系列答案
相关题目
下列各组离子,能在溶液中大量共存的是( )
| A、Mg2+、Na+、Cl-、OH- |
| B、Na+、H+、OH-、SO32- |
| C、K+、Fe3+、OH-、SO42- |
| D、K+、H+、SO42-、NO3- |
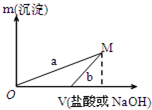 某同学设计了两种方案制备氢氧化铝.
某同学设计了两种方案制备氢氧化铝.方案一:2.7g Al
| 100mL稀盐酸 |
| NaOH溶液 |
方案二:2.7g Al
| 100mLNaOH溶液 |
| 稀盐酸 |
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
| A、a曲线表示的是向X溶液中加入NaOH溶液 |
| B、在M点时,两种方案中所得溶液的溶质质量分数相同 |
| C、方案二比方案一生成更多的气体 |
| D、M点以后,a、b两条曲线将重合为一条 |
既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
| A、①②③ | B、②③ |
| C、②④ | D、①②③④ |
某有机物可被氧化为甲、也可被还原为乙,甲和乙都能跟钠反应放出氢气,且甲、乙在浓硫酸催化下反应生成丙,丙能发生银镜反应,丙的结构简式是( )
| A、CH3COOCH3 |
| B、HCOOCH3 |
| C、HCOOCH2CH3 |
| D、HCOOCH2CH2CH3 |
氯化铵溶液中离子浓度从大到小排列正确的是( )
| A、NH4+、H+、OH-、Cl- |
| B、Cl-、NH4+、H+、OH- |
| C、H+、Cl-、NH4+、OH- |
| D、Cl-、NH4+、OH-、H+ |