题目内容
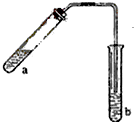 哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:①试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序是
②为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是
③试管b中加有饱和Na2CO3溶液,其作用是
④反应结束后,振荡试管b,静置.观察到的现象是
考点:乙酸乙酯的制取
专题:实验题
分析:①浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
②液体加热要加碎瓷片,防止暴沸;
③饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
④根据乙酸乙酯的水溶性、密度、状态等方面进行解答.
②液体加热要加碎瓷片,防止暴沸;
③饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
④根据乙酸乙酯的水溶性、密度、状态等方面进行解答.
解答:
解:①为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,乙酸易挥发,冷却后再加入乙酸,
故答案为:先加入乙醇,再加入浓硫酸,最后加入醋酸;或者先加入乙醇,再加入醋酸,最后加入浓硫酸;
②液体乙酸乙醇沸点低,加热时容易发生暴沸,所以需要要加入碎瓷片,防止暴沸,故答案为:加入碎瓷片或者沸石;
③制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:吸收乙醇,反应掉乙酸,降低乙酸乙酯在水中的溶解度;
④乙酸乙酯,其密度比水小,所以在碳酸钠溶液层上方有无色油状液体出现,故答案为:液体分层,上层为无色油状液体.
故答案为:先加入乙醇,再加入浓硫酸,最后加入醋酸;或者先加入乙醇,再加入醋酸,最后加入浓硫酸;
②液体乙酸乙醇沸点低,加热时容易发生暴沸,所以需要要加入碎瓷片,防止暴沸,故答案为:加入碎瓷片或者沸石;
③制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:吸收乙醇,反应掉乙酸,降低乙酸乙酯在水中的溶解度;
④乙酸乙酯,其密度比水小,所以在碳酸钠溶液层上方有无色油状液体出现,故答案为:液体分层,上层为无色油状液体.
点评:本题考查了乙酸乙酯的制备,题目难度不大,注意掌握酯化反应的原理及实验室制法,明确正确的实验基本操作方法及注意事项为解答本题的关键,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、向Ba(OH)2溶液中加入过量的NH4HSO4溶液Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3?H2O+H2O |
| B、工业上用石灰乳制漂粉精:2OH-+Cl2=Ca2++Cl-+ClO-+H2O |
| C、向漂白粉溶液中通入一定量的SO2Ca2++3ClO-+SO2+H2O=CaSO4+Cl-+2HClO |
| D、向100mL 0.1mol/L NaOH溶液中滴入数滴0.2mol/L Ca(HCO3)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
原子核外每个电子层上均含有2n2个电子的元素是( )
| A、Be | B、C | C、Ar | D、Ne |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、7.8g Na2O2含有的阴离子数目为0.2NA |
| B、PH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA |
| C、25℃时,1.0L pH=9的CH3COONa溶液中H+和CH3COOH的总数目为10-5NA |
| D、己知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ?mol-1 (Q>0),则将2NA 个SO2分子和NA 个O2,分子置于一密闭容器中充分反应后放出QkJ的 热量 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、铁与足量稀硝酸反应,1 mol Fe失去电子数为3NA |
| B、常温常压下,22.4L 乙烯中含极性共价键数目为5NA |
| C、1 mol Cu与足量浓硫酸反应产生2NA个SO2分子 |
| D、1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA |
下列研究分析方法正确的是( )
| A、分别测定SO2、CO2饱和溶液的PH,可比较H2SO3、H2CO3二酸的强弱 |
| B、先滴入少量氯水,后滴入KSCN试液,可确定溶液中是否含Fe2+ |
| C、25℃若测知氨水与NH4Cl混合溶液的pH>7,可确定溶液中c(NH4+)>c(Cl-) |
| D、固体NH2COONH4(s)在密闭容器中存在:NH2COONH4(s)?2NH3(g)+CO2(g)△S>0,由此可确定反应的△H<0 |
 实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:
实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格: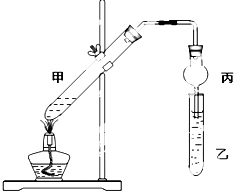 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.