题目内容
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、7.8g Na2O2含有的阴离子数目为0.2NA |
| B、PH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA |
| C、25℃时,1.0L pH=9的CH3COONa溶液中H+和CH3COOH的总数目为10-5NA |
| D、己知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ?mol-1 (Q>0),则将2NA 个SO2分子和NA 个O2,分子置于一密闭容器中充分反应后放出QkJ的 热量 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.过氧化钠中的阴离子为过氧根离子,0.1mol过氧化钠中含有0.1mol阴离子;
B.缺少醋酸溶液的体积,无法计算溶液中氢离子的物质的量;
C.醋酸钠溶液水电离的氢离子与氢氧根离子的物质的量相等,根据质子守恒判断;
D.可逆反应中,反应物不可能完全转化成生成物,则放出的热量小于QkJ.
B.缺少醋酸溶液的体积,无法计算溶液中氢离子的物质的量;
C.醋酸钠溶液水电离的氢离子与氢氧根离子的物质的量相等,根据质子守恒判断;
D.可逆反应中,反应物不可能完全转化成生成物,则放出的热量小于QkJ.
解答:
解:A.7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.1mol阴离子过氧根离子,含有的阴离子数目为0.1NA,故A错误;
B.没有告诉醋酸溶液的体积,无法计算溶液中氢离子的数目,故B错误;
C.根据醋酸钠溶液中质子守恒可知,H+和CH3COOH的物质的量等于氢氧根离子的物质的量,1.0L pH=9的CH3COONa溶液中含有氢氧根离子的物质的量为10-5mol,则溶液中H+和CH3COOH的总数目为10-5NA,故C正确;
D.该反应为可逆反应,2NA个SO2分子的物质的量为2mol、NA个O2分子物质的量为1mol,二者完全反应生成的三氧化硫一定小于2mol,则放出的热量小于QkJ,故D错误;
故选C.
B.没有告诉醋酸溶液的体积,无法计算溶液中氢离子的数目,故B错误;
C.根据醋酸钠溶液中质子守恒可知,H+和CH3COOH的物质的量等于氢氧根离子的物质的量,1.0L pH=9的CH3COONa溶液中含有氢氧根离子的物质的量为10-5mol,则溶液中H+和CH3COOH的总数目为10-5NA,故C正确;
D.该反应为可逆反应,2NA个SO2分子的物质的量为2mol、NA个O2分子物质的量为1mol,二者完全反应生成的三氧化硫一定小于2mol,则放出的热量小于QkJ,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的综合应用、可逆反应特点,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系,明确可逆反应中反应物不可能完全转化成生成物,选项C注意使用质子守恒进行计算.

练习册系列答案
相关题目
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体.在同温同压下,两容器内的气体一定具有相同的( )
| A、原子总数 | B、密度 |
| C、质量 | D、质子总数 |
若将7N原子的电子排布图画成 ,它违背了( )
,它违背了( )
 ,它违背了( )
,它违背了( )| A、能量守恒原理 |
| B、泡利不相容原理 |
| C、洪特规则 |
| D、能量最低原理 |
某学生在实验室制取乙酸乙酯(反应温度80℃左右)和乙酸丁酯(反应温度115~125℃),现有两套实验装置图Ⅰ和图Ⅱ.下列说法错误的是( )
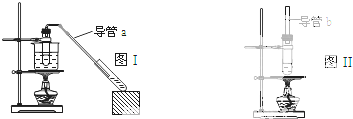

| A、制乙酸乙酯用图I装置,制乙酸丁酯用图II 装置 |
| B、导管a和导管b的作用都是冷凝回流 |
| C、都可用Na2CO3 溶液来洗去酯中的酸和醇 |
| D、加入过量的乙酸可以提高醇的转化率 |
 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3 某校研究性学习小组取得了两种牌号的水滑石样品拟进行探究,请回答相关问题.
某校研究性学习小组取得了两种牌号的水滑石样品拟进行探究,请回答相关问题.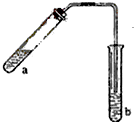 哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: