题目内容
下列反应的离子方程式正确的是( )
| A、向Ba(OH)2溶液中加入过量的NH4HSO4溶液Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3?H2O+H2O |
| B、工业上用石灰乳制漂粉精:2OH-+Cl2=Ca2++Cl-+ClO-+H2O |
| C、向漂白粉溶液中通入一定量的SO2Ca2++3ClO-+SO2+H2O=CaSO4+Cl-+2HClO |
| D、向100mL 0.1mol/L NaOH溶液中滴入数滴0.2mol/L Ca(HCO3)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、设量少的为“1”,据此写出离子方程式;
B、电荷不守恒;
C、SO2具有还原性,而漂白粉具有氧化性,故发生氧化还原反应;
D、设量少的为“1”,据此写出离子方程式;
B、电荷不守恒;
C、SO2具有还原性,而漂白粉具有氧化性,故发生氧化还原反应;
D、设量少的为“1”,据此写出离子方程式;
解答:
解:A、设量少的Ba(OH)2为1mol,则消耗2molH+和1molSO42-,故离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A错误;
B、工业上制漂粉精的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,故B错误;
C、SO2具有还原性,而漂白粉具有氧化性,故SO2被氧化为CaSO4,而ClO-被还原为Cl-,故离子方程式为:Ca2++3ClO-+SO2+H2O=CaSO4+Cl-+2HClO,故C正确;
D、设量少的Ca(HCO3)2为1mol,则2molHCO3-消耗2molOH-生成2molH2O和2molCO32-,再和1molCa2+,故离子方程式为:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故D错误.
故选C.
B、工业上制漂粉精的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,故B错误;
C、SO2具有还原性,而漂白粉具有氧化性,故SO2被氧化为CaSO4,而ClO-被还原为Cl-,故离子方程式为:Ca2++3ClO-+SO2+H2O=CaSO4+Cl-+2HClO,故C正确;
D、设量少的Ca(HCO3)2为1mol,则2molHCO3-消耗2molOH-生成2molH2O和2molCO32-,再和1molCa2+,故离子方程式为:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故D错误.
故选C.
点评:本题考查了离子方程式的书写,应注意量对离子方程式书写的影响,难度不大.

练习册系列答案
相关题目
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体.在同温同压下,两容器内的气体一定具有相同的( )
| A、原子总数 | B、密度 |
| C、质量 | D、质子总数 |
下列说法正确的是( )
| A、摩尔既是表示微粒,又是表示质量的单位 |
| B、1mol氧的质量等于16g |
| C、氢氧化钠的摩尔质量是40g |
| D、氩气的摩尔质量(以g/molWei单位)在数值上等于它的相对原子质量 |
下列实验对应的离子方程式正确的是( )
| A、用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ |
| B、Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| C、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| D、用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++7H2O2═2Mn2++6O2↑+10H2O |
若将7N原子的电子排布图画成 ,它违背了( )
,它违背了( )
 ,它违背了( )
,它违背了( )| A、能量守恒原理 |
| B、泡利不相容原理 |
| C、洪特规则 |
| D、能量最低原理 |
 已知化学反应N2+3H2═2NH3的能量变化如图所示:
已知化学反应N2+3H2═2NH3的能量变化如图所示: 现有一盛有无色固体物质M的试剂瓶,标签已破损(如图).已知硫酸、盐酸、硝酸等是强酸,碳酸、氢硫酸、亚硫酸、醋酸等是弱酸,烧碱、苛性钾等是强碱,一水合氨等是弱碱.由强酸与强碱组成的正盐呈中性,由强酸弱碱组成的正盐呈酸性,由弱酸强碱组成的正盐呈碱性.
现有一盛有无色固体物质M的试剂瓶,标签已破损(如图).已知硫酸、盐酸、硝酸等是强酸,碳酸、氢硫酸、亚硫酸、醋酸等是弱酸,烧碱、苛性钾等是强碱,一水合氨等是弱碱.由强酸与强碱组成的正盐呈中性,由强酸弱碱组成的正盐呈酸性,由弱酸强碱组成的正盐呈碱性. 【物质结构域性质】
【物质结构域性质】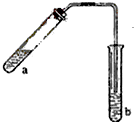 哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: