题目内容
12.化学与社会可持续发展密切相关.下列做法不合理的是( )| A. | CO2和氢气合成甲烷,实现“碳循环” | |
| B. | 提倡步行、骑自行车、乘公交车等“低碳”出行方式 | |
| C. | 采用纳米TiO2光触媒技术将装修材料中释放的HCHO转化为无害物质 | |
| D. | 将造纸废水通过高压水井压到地下或溶洞中,减少对地表水的污染 |
分析 A.CO2+4H2 $\frac{\underline{催化剂}}{△}$CH4+2H2O,减少二氧化碳排放;
B.提倡步行、骑自行车、乘公交车等均减少二氧化碳排放;
C.释放的HCHO转化为无害物质,减少对环境的污染;
D.废水中含有毒、有害物质污染地下水.
解答 解:A.CO2+4H2 $\frac{\underline{催化剂}}{△}$CH4+2H2O,减少二氧化碳排放,则实现“碳循环”,故A正确;
B.提倡步行、骑自行车、乘公交车等均减少二氧化碳排放,则“低碳”出行方式应大力提倡,故B正确;
C.释放的HCHO转化为无害物质,减少对环境的污染,则采用纳米TiO2光触媒技术将装修材料中释放的HCHO转化为无害物质合理,故C正确;
D.废水中含有毒、有害物质污染地下水,做法不合理,故D错误;
故选D.
点评 本题考查物质的性质及应用,为高频考点,侧重于分析与应用能力的考查,注意把握物质的性质、环境保护、化学与生活的关系为解答该题的关键,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
2.下列离子方程式与所述事实相符且书写正确的是( )
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 高锰酸钾在酸性介质中与草酸反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8 H2O | |
| C. | FeCl2与K3[Fe(CN)6]反应:2Fe2++3[Fe(CN)6]3-═Fe2[Fe(CN)6]3↓ | |
| D. | 向KI和H2SO4的混合溶液中通入空气:4H++4I-+O2=2I2+2H2O |
3.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+、K+等8种离子中的某几种.取该溶液进行实验,得到如下现象:( )
①向溶液中滴加过量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断:该溶液中存在的离子组可能是.
①向溶液中滴加过量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断:该溶液中存在的离子组可能是.
| A. | Al3+、Mg2+、SO32- | B. | K+、CO32-、I- | C. | Al3+、CO32-、I- | D. | Na+、Br-、CO32- |
7.下列物质性质与应用的因果关系正确的是( )
| A. | 液氨气化吸收大量热,可做制冷剂 | |
| B. | 晶体硅用于制作半导体材料是因其熔点高、硬度大 | |
| C. | 二氧化锰具有强氧化性,故能将双氧水氧化为氧气 | |
| D. | Fe比Cu活泼,所以FeCl3溶液可以腐蚀线路板上的Cu |
17.I:工业制硫酸时,利用接触氧化反应将SO 2转化为SO3是一个关键步骤.
(1)某温度下,2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0 mol O2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(mol/L)-1(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件
(以V2O5作催化剂)温度450℃;压强1×105Pa,选择此压强的理由再增压转化率增大不明显,加大成本
(4)能判断该反应达到平衡状态的依据是ACF
A.容器的压强不变 B.混合气体的密度不变 C.混合气体中SO3的浓度不变
D.c(SO2)=c(SO3) E.v正(SO2)=v 正(SO3) F.v正(SO3)=2v逆(O2)
(1)某温度下,2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0 mol O2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(mol/L)-1(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件
(以V2O5作催化剂)温度450℃;压强1×105Pa,选择此压强的理由再增压转化率增大不明显,加大成本
| 1×l05 Pa | 5×l05 Pa | 10×l05 Pa | 50×l05 Pa | 100×l05 Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
A.容器的压强不变 B.混合气体的密度不变 C.混合气体中SO3的浓度不变
D.c(SO2)=c(SO3) E.v正(SO2)=v 正(SO3) F.v正(SO3)=2v逆(O2)
4.如表是元素周期表的前四周期:
回答下列问题:
(1)G元素与E元素形成的化合物的化学式可能是Na2O、Na2O2,I与J的原子序数相差为18.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(用化合物的化学式表示,下同),酸性最强的是HClO4,E、F、G三种元素形成的简单离子半径由大到小的顺序是O2->F->Na+(用离子符号回答).
| I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | |||||
| 四 | J |
(1)G元素与E元素形成的化合物的化学式可能是Na2O、Na2O2,I与J的原子序数相差为18.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(用化合物的化学式表示,下同),酸性最强的是HClO4,E、F、G三种元素形成的简单离子半径由大到小的顺序是O2->F->Na+(用离子符号回答).
1.NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 标准状况下,11.2L N2和O2混合气体中所含分子数为0.5NA | |
| B. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4NA | |
| C. | 常温常压下,20g ND3中所含质子数为10NA | |
| D. | 向含0.2mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目为NA |
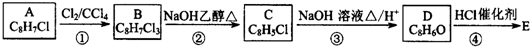
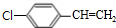 ,B中含有的官能团是氯原子.
,B中含有的官能团是氯原子.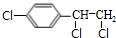 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$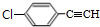 +2NaCl+2H2O,其反应类型为消去反应.
+2NaCl+2H2O,其反应类型为消去反应.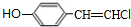 ;
;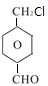 、
、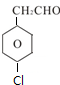 .
.