题目内容
19.已知35Cl是质子数为17,相对原子质量为35的氯原子;37Cl是指质子数为17,相对原子质量为37的氯原子.反应K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O,有关叙述正确的是( )| A. | KCl中含有35Cl | |
| B. | 生成物Cl2的平均相对分子质量为73.3 | |
| C. | 1molK35ClO3参加反应,失去电子数为5NA | |
| D. | 氧化剂和还原剂的物质的量之比1:6 |
分析 该反应中Cl元素化合价由+5价、-1价变为0价,有$\frac{1}{6}$的HCl不作还原剂,起酸的作用,氧化剂是K35ClO3、还原剂 H37Cl,据此分析解答.
解答 解:A.HCl→KCl时Cl元素化合价不变,HCl起酸的作用,所以KCl中含有37Cl,故A错误;
B.生成氯气的相对分子质量=$\frac{35×1+37×5}{3}$=73.3,故B正确;
C.该反应转移的电子数为5e-,则1molK35ClO3参加反应,得到电子数为5NA,故C错误;
D.氧化剂是K35ClO3、还原剂是$\frac{5}{6}$的 H37Cl,所以氧化剂和还原剂的物质的量之比为1:5,故D错误;
故选B.
点评 本题考查了氧化还原反应,明确元素化合价转化是解本题关键,易错点是氯气相对分子质量的计算方法,题目难度不大.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 | |
| B. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 | |
| C. | 在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 | |
| D. | 研制性能优良的催化剂既可以提高化学反应速率,又能起到很好的节能效果 |
10.某学生做完实验后,采用下列方法清洗所用仪器:
①用稀硝酸清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗沾有硫磺的试管
下列对以上操作的判断.正确的是( )
①用稀硝酸清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗沾有硫磺的试管
下列对以上操作的判断.正确的是( )
| A. | 除④外都对 | B. | 除⑤外都对 | C. | ④⑤不对 | D. | 全都正确 |
7.在由水电离产生的H+的浓度为1×10-13 mol•L-1的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3-、S2-
②K+、Fe2+、I-、SO42-
③Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤K+、Ba2+、Cl-、NO3-.
①K+、Cl-、NO3-、S2-
②K+、Fe2+、I-、SO42-
③Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤K+、Ba2+、Cl-、NO3-.
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
3.某研究性学习小组为研究影响化学反应速率的因素,设计如下方案:
已知:反应的方程式(未配平):KMnO4+H2C2O4+H2SO4-K2SO4+CO2↑+H2O.
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
(4)利用反应6NO2+8NH3═7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示.
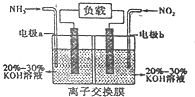
①电极a为负极,其电极反应式为2NH3-6e-+60H-=N2+6H2O.
②当有2.24L NO2(标准状况下)被处理时,转移电子为0.4mol.
③为使电池持续放电,该离子交换膜需选用阴离子交换膜.
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
(4)利用反应6NO2+8NH3═7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示.

①电极a为负极,其电极反应式为2NH3-6e-+60H-=N2+6H2O.
②当有2.24L NO2(标准状况下)被处理时,转移电子为0.4mol.
③为使电池持续放电,该离子交换膜需选用阴离子交换膜.
8.下面有四种有机物,用提供的试剂分别鉴别,将所用试剂及产生的现象的序号填在相应横线上.
①cB②bC③dA④aD
①cB②bC③dA④aD
| 有机物 | 试剂 | 现象 |
| ①淀粉 ②苯乙烯 ③苯酚 ④蛋白质 | a.浓硝酸 b.酸性高锰酸钾溶液 c.碘水 d.FeCl3溶液 | A.呈紫色 B.呈蓝色 C.紫色褪去 D.呈黄色 |