题目内容
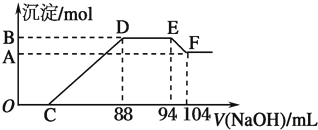
14.倍半碳酸钠(Na2CO3•NaHCO3•2H2O),是常见的典型天然碱矿物,有时专称它为天然碱,又叫做碱石,取22.6g倍半碳酸钠分为质量相等的两份,第一份加热至质量不再变化为止,残留固体质量为xg;第二份溶于水配成100mL溶液,然后逐滴滴入稀硫酸直至没有气体放出为止,用去稀硫酸体积25.0mL.求:(1)倍半碳酸钠(Na2CO3•NaHCO3•2H2O)晶体中阴阳离子个数比2:3;
(2)x值7.95(取3位有效数字);
(3)稀硫酸物质的量浓度3mol/L.
分析 (1)Na2CO3、NaHCO3的物质的量之比为1:1,据此确定阴阳离子数目之比;
(2)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,最终残留固体为Na2CO3,根据钠离子守恒计算最终Na2CO3的物质的量,再根据m=nM计算其质量;
(3)另一份与硫酸反应生成Na2SO4、二氧化碳与水,根据钠离子守恒2n(Na2SO4)=3n(Na2CO3•NaHCO3•2H2O),根据硫酸根守恒可知:n(H2SO4)=n(Na2SO4),进而计算硫酸的浓度.
解答 解:(1)Na2CO3、NaHCO3的物质的量之比为1:1,则阴阳离子数目之比为2:3,
故答案为:2:3;
(2)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,最终残留固体为Na2CO3,每一份中Na2CO3•NaHCO3•2H2O的物质的量为$\frac{\frac{22.6g}{2}}{226g/mol}$=0.05mol,根据钠离子守恒最终Na2CO3的物质的量为$\frac{0.05mol×3}{2}$=0.075mol,故其质量为0.075mol×106g/mol=7.95g,
故答案为:7.95;
(3)另一份与硫酸反应生成Na2SO4、二氧化碳与水,根据钠离子守恒2n(Na2SO4)=3n(Na2CO3•NaHCO3•2H2O),则n(Na2SO4)=$\frac{3}{2}$×0.05mol=0.075mol,根据硫酸根守恒可知:n(H2SO4)=n(Na2SO4)=0.075mol,则硫酸的浓度为$\frac{0.075mol}{0.025L}$=3mol/L,
故答案为:3mol/L.
点评 本题考查混合物有关计算,侧重考查学生分析计算能力,注意利用守恒法计算解答.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案①检查装置气密性后,在各仪器中添加相应试剂.
②打开弹簧夹K1~K4,通入一段时间N2,将T型管插入B中,继续通入N2,然后关闭K1、K3、K4.
③打开活塞a,滴加一定量的浓盐酸,加热A.
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
⑦更换试管D,重复过程⑤,检验B溶液中的离子.
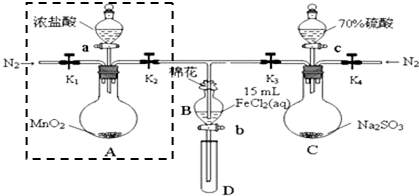
试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是关闭K1、K2,打开分液漏斗的盖子和活塞,向其中加入水,一段时间后分液漏斗尖嘴处不再滴液即证明气密性良好.
(2)C中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+.
(4)B中的棉花通常会浸润NaOH溶液试剂;实验②中通入N2的作用是排除装置中的空气,防止FeCl2溶液被O2氧化.
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性 Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程⑤B溶液中含有的离子 | 过程⑦B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.某同学设计如下实验,证实该假设成立:
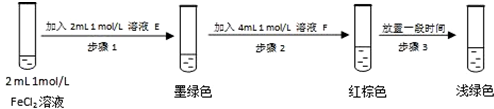
①溶液E和F分别为Na2SO3(或可溶性亚硫酸盐)、FeCl3.
②请结合方程式和化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因Fe3+与SO32-反应Fe3++SO32-=Fe2++SO42-,使c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色.
| A. | 平衡正向移动 | B. | 平衡逆向移动 | ||
| C. | 正逆反应速率都增大 | D. | NH3的质量分数增加 |
| A. | KCl中含有35Cl | |
| B. | 生成物Cl2的平均相对分子质量为73.3 | |
| C. | 1molK35ClO3参加反应,失去电子数为5NA | |
| D. | 氧化剂和还原剂的物质的量之比1:6 |
| A. | 乙烯聚合为聚乙烯高分子材料符合绿色化学原子经济性要求 | |
| B. | 银制品久置干燥空气中因电化学腐蚀而使表面变暗 | |
| C. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| D. | 在合成洗涤剂中添加酶制剂可以提高洗涤效果 |