题目内容
3.某研究性学习小组为研究影响化学反应速率的因素,设计如下方案:| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
(4)利用反应6NO2+8NH3═7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示.
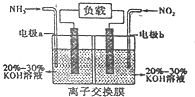
①电极a为负极,其电极反应式为2NH3-6e-+60H-=N2+6H2O.
②当有2.24L NO2(标准状况下)被处理时,转移电子为0.4mol.
③为使电池持续放电,该离子交换膜需选用阴离子交换膜.
分析 (1)溶液混合后显示紫红色,当紫红色褪去后计时结束;
(2)实验I和II研究浓度对反应速率的影响;实验I和III研究温度对反应速率的影响;
(3)MnSO4溶液为催化剂;
(4)由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应,结合电解质溶液呈碱性解答.
解答 解:(1)实验计时方法是从溶液混合开始记时,到紫红色刚好褪去计时结束,故答案为:紫红色刚好褪去;
(2)根据实验目的,选择合理数据:高锰酸钾作为指示剂,浓度不变,都是2mL;实验I和II研究浓度对反应速率的影响,草酸体积为1mL;实验I和III研究温度对反应速率的影响,浓度全部相同,
故答案为:
| II | 2 | 1 | |
III | 2 | 2 | 0 |
(4)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则a为负极,b为正极,负极电极方程式为2NH3-6e-+60H-=N2+6H2O,
故答案为:负;2NH3-6e-+60H-=N2+6H2O;
②当有2.24L NO2(标准状况)即0.1mol 被处理时,转移电子为0.1mol×(4-0)=0.4mol,故答案为:0.4;
③原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,
故答案为:阴离子.
点评 本题考查影响化学反应速率的因素、电极反应式书写、电解池反应原理等,需要认真分析题中信息,得出合理结论,本题难度中等.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
14.常温下,对于0.1mol•L-1的氨水,下列说法正确的是( )
| A. | 加水稀释后,溶液中c(H+)减小 | |
| B. | 加入少量NaOH固体,电离度增大,溶液的pH增大 | |
| C. | 加入少量NH4Cl固体,氨水电离平衡向右移动 | |
| D. | 通入少量HCl气体后,电离平衡常数不变 |
12. 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
(1)用图甲装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
②大小烧杯之间填满纸屑的作用是保温、隔热、减少实验过程中的热量散失.
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值偏低(填“偏高”、“偏低”或“无影响”).
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸.其具体实验步骤如下:
①应选择b滴定管(填写图乙中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中.再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,观察到锥形瓶中溶液的颜色由无色变为浅红色,且半分钟不褪色即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
测得未知稀盐酸的物质的量浓度为0.096mol/L(保留小数点后3位).
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.(1)用图甲装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
②大小烧杯之间填满纸屑的作用是保温、隔热、减少实验过程中的热量散失.
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值偏低(填“偏高”、“偏低”或“无影响”).
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸.其具体实验步骤如下:
①应选择b滴定管(填写图乙中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中.再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,观察到锥形瓶中溶液的颜色由无色变为浅红色,且半分钟不褪色即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
19.已知35Cl是质子数为17,相对原子质量为35的氯原子;37Cl是指质子数为17,相对原子质量为37的氯原子.反应K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O,有关叙述正确的是( )
| A. | KCl中含有35Cl | |
| B. | 生成物Cl2的平均相对分子质量为73.3 | |
| C. | 1molK35ClO3参加反应,失去电子数为5NA | |
| D. | 氧化剂和还原剂的物质的量之比1:6 |
8.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有CuSO4+Zn=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率.
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4.
(4)要加快上述实验中氢气生成速率,还可采取的措施有升温;增加H2SO4浓度 (答两种即可).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10.
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积.
(1)上述实验中发生反应的化学方程式有CuSO4+Zn=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率.
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4.
(4)要加快上述实验中氢气生成速率,还可采取的措施有升温;增加H2SO4浓度 (答两种即可).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积.
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.