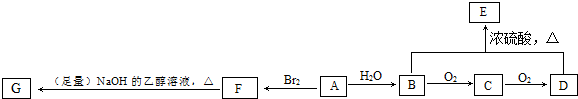
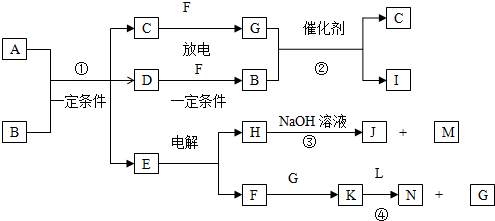
题目内容
9.下列反应的离子方程式书写正确的是( )| A. | 氢氧化钠溶液中通入氯气:Cl2+OH-═ClO-+Cl-+H2O | |
| B. | 铁与硫酸铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 碳酸氢钠溶液中滴入氢氧化钠溶液:OH-+HCO${\;}_{3}^{-}$═H2O+CO2↑ |
分析 A.离子方程式两边负电荷不相等,违反了电荷守恒;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.氢氧化镁与稀盐酸反应生成氯化镁和水,氢氧化镁需要保留化学式;
D.碳酸氢钠与氢氧化钠反应生成碳酸钠和水,不会生成二氧化碳气体.
解答 解:A.氢氧化钠溶液中通入氯气,反应生成氯化钠、次氯酸钠和水,正确的离子方程式为:Cl2+2OH-═ClO-+Cl-+H2O,故A错误;
B.铁与硫酸铁溶液反应生成硫酸亚铁,正确的离子方程式为:Fe+2Fe3+═3Fe2+,故B错误;
C.氢氧化镁与稀盐酸反应的离子方程式为:Mg(OH)2+2H+═Mg2++2H2O,故C正确;
D.碳酸氢钠溶液中滴入氢氧化钠溶液,反应生成碳酸钠和水,正确的离子方程式为:OH-+HCO3-═CO32-+H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
19.下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法:
| 物质 | 杂质 | 除杂试剂或方法 |
| (1)FeCl3溶液 | FeCl2 | |
| (2)FeCl2溶液 | FeCl3 | |
| (3)FeSO4溶液 | CuSO4 | |
| (4)Na2CO3 | NaHCO3 | |
| (5)Mg (OH)2 | Al(OH)3 | , |
20.实验室欲用NaOH固体配制1.00mol/L的NaOH溶液250mL,在配制过程中其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是( )
| A. | 没有洗涤烧杯和玻璃棒 | |
| B. | 转移溶液时不慎有少量洒到容量瓶外面 | |
| C. | 容量瓶不干燥,含有少量蒸馏水 | |
| D. | 定容时俯视刻度线 |
17.如图所示,甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的是( )
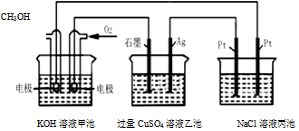

| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g | |
| D. | 反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度 |
1.下列事实能说明亚硝酸是弱电解质的是( )
| A. | pH=4的亚硝酸溶液c(H+)=1×10-4mol/L | |
| B. | 用亚硝酸溶液作导电实验,灯泡很暗 | |
| C. | 将Vml pH=4的亚硝酸稀释成pH=5的溶液,所需加入的水量大于10Vml | |
| D. | 10mL 1mol/L的亚硝酸恰好与10mL 1mol/L NaOH溶液完全中和 |