题目内容
18.依据事实,写出下列反应的热化学方程式(1)已知1g碳粉在氧气中完全燃烧放出的热量是32.8kJ,试写出相关的热化学方程式C(s)+O2(g)=CO2( g)△H=-393.6 kJ/mol
(2)在25℃、101kPa下,2g甲烷(CH4)燃烧生成CO2和液态水时放热25kJ.则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-200KJ•mol-1.
分析 (1)根据热化学方程式的书写方法以及意义来书写,应注意化学计量数与反应热的对应关系及各物质的聚集状态来解答.
(2)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物.
解答 解:1g碳粉在氧气中完全燃烧放出的热量是32.8kJ,12g碳粉在氧气中完全燃烧并放出393.6kJ热量,则热化学方程式为:C(s)+O2(g)=CO2( g)△H=-393.6 kJ/mol;
故答案为:C(s)+O2(g)=CO2( g)△H=-393.6 kJ/mol;
(2)在25℃、101kPa下,2g甲烷燃烧生成CO2和液态水时放热25kJ,则16g甲烷完全燃烧生成二氧化碳和液态水放出的热量为8×25KJ=200KJ,
则甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-200KJ•mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-200KJ•mol-1.
点评 本题考查燃烧热的热化学方程式的书写,题目难度不大,注意表示燃烧热的热化学方程式,可燃物为1mol,生成物为稳定的氧化物.

练习册系列答案
相关题目
8.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023mol-1 | |
| B. | 28g乙烯所含共用电子对数目为4×6.02×1023mol-1 | |
| C. | 1mol 苯中含有碳碳双键的数目为3×6.02×1023mol-1 | |
| D. | 2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023mol-1 |
9.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化钠溶液中通入氯气:Cl2+OH-═ClO-+Cl-+H2O | |
| B. | 铁与硫酸铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 碳酸氢钠溶液中滴入氢氧化钠溶液:OH-+HCO${\;}_{3}^{-}$═H2O+CO2↑ |
3.下列关于Fe3+、Fe2+性质实验的说法错误的是( )
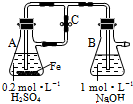

| A. | 用图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
10.下列事实不能用勒夏特列原理解释的是( )
| A. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| B. | 在沸腾的蒸馏水中滴加饱和FeCl3溶液,制Fe(OH)3胶体 | |
| C. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| D. | 用排饱和食盐水的方法收集氯气 |
7.下列除杂质的操作中不正确的是( )
| A. | SO2中混有HCl:将其通入Na2SO3溶液 | |
| B. | NaHCO3溶液中混有少量的Na2CO3:往该溶液中通入过量的CO2气体 | |
| C. | 铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤 | |
| D. | FeCl2溶液中混有少量FeCl3:加入适量铁粉 |
8.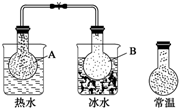 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )| A. | 反应2NO2(g)?N2O4(g)的正反应为吸热反应 | |
| B. | 上述过程中,A烧瓶内正、逆反应速率均加快 | |
| C. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 | |
| D. | 上述过程中,A、B烧瓶内气体密度均保持不变 |