题目内容
17.如图所示,甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的是( )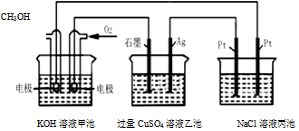
| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g | |
| D. | 反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度 |
分析 甲池中能发生自发的氧化还原反应,属于原电池,通入甲醇的一极为负极,通入氧气的一极为正极,则石墨为阳极,Ag为阴极,左侧的Pt为阳极,右侧的Pt为阴极,
A.甲池是原电池,乙、丙为电解池;
B.碱性条件下不能生成氢离子;
C.乙池中阳极生成氧气,电极上生成铜,根据电子守恒计算;
D.电解池中,电解后的溶液复原遵循:出什么加什么的思想.
解答 解:A.甲池中投放甲醇的电极是负极,投放氧气的电极是正极,所以石墨连接甲池的正极,为电解池的阳极,电解硫酸铜溶液,阳极生成氧气,故A错误;
B.在燃料电池中,负极是甲醇发生失电子的氧化反应,在碱性电解质下的电极反应为CH3OH-6e-+2H2O+8OH-=CO32-+8H2O,故B错误;
C.甲池中消耗280mL(标准状况下)O2,氧气的物质的量为0.0125mol,则转移电子0.05mol,根据转移电子守恒知,乙池中Ag电极生成0.025molCu,则Cu的质量=0.025mol×64g/mol=1.6g,故C正确;
D.电解池丙池中,电解后生成氢氧化钠、氢气和氯气,要想复原,要加入HCl,加盐酸会增大水的量,故D错误.
故选C.
点评 本题考查了原电池和电解池原理,题目难度不大,注意把握燃料电池原理和电解原理,注意书写电极反应式时要结合电解质溶液的酸碱性,电解质溶液不同电极反应式不同,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
7.下列实验操作错误的是( )
| A. | 为防止试管破裂,加热固体碳酸氢钠时,试管口应略向下倾斜 | |
| B. | 为防止液体暴沸,蒸馏时可在烧瓶中加入少量碎瓷片 | |
| C. | 容量瓶可用于配制一定物质的量浓度的溶液,不可作为反应容器使用 | |
| D. | 配制500mL 0.1 mol/L NaOH溶液时,将2g NaOH固体倒入500mL容量瓶中,加水至凹液面与刻度线相切 |
8.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023mol-1 | |
| B. | 28g乙烯所含共用电子对数目为4×6.02×1023mol-1 | |
| C. | 1mol 苯中含有碳碳双键的数目为3×6.02×1023mol-1 | |
| D. | 2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023mol-1 |
9.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化钠溶液中通入氯气:Cl2+OH-═ClO-+Cl-+H2O | |
| B. | 铁与硫酸铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 碳酸氢钠溶液中滴入氢氧化钠溶液:OH-+HCO${\;}_{3}^{-}$═H2O+CO2↑ |
7.下列除杂质的操作中不正确的是( )
| A. | SO2中混有HCl:将其通入Na2SO3溶液 | |
| B. | NaHCO3溶液中混有少量的Na2CO3:往该溶液中通入过量的CO2气体 | |
| C. | 铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤 | |
| D. | FeCl2溶液中混有少量FeCl3:加入适量铁粉 |