题目内容
19.下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法:| 物质 | 杂质 | 除杂试剂或方法 |
| (1)FeCl3溶液 | FeCl2 | |
| (2)FeCl2溶液 | FeCl3 | |
| (3)FeSO4溶液 | CuSO4 | |
| (4)Na2CO3 | NaHCO3 | |
| (5)Mg (OH)2 | Al(OH)3 | , |
分析 (1)氯化亚铁与氯气反应生成氯化铁;
(2)Fe与氯化铁反应生成氯化亚铁;
(3)Fe与硫酸铜反应生成硫酸亚铁和Cu;
(4)碳酸氢钠加热分解生成碳酸钠;
(5)氢氧化铝和NaOH反应,而氢氧化镁不能.
解答 解:(1)氯化亚铁与氯气反应生成氯化铁,则通Cl2或加氯水可除杂;
(2)Fe与氯化铁反应生成氯化亚铁,则加铁粉、过滤可除杂;
(3)Fe与硫酸铜反应生成硫酸亚铁和Cu,则加铁粉、过滤可除杂;
(4)碳酸氢钠加热分解生成碳酸钠,则加热可除杂;
(5)氢氧化铝和NaOH反应,而氢氧化镁不能,则加NaOH溶液、过滤可除杂,
故答案为:
| 物质 | 杂质 | 除杂试剂或方法 |
| (1)FeCl3溶液 | FeCl2 | 通Cl2或加氯水 |
| (2)FeCl2溶液 | FeCl3 | 加铁粉 过滤 |
| (3)FeSO4溶液 | CuSO4 | 加铁粉 过滤 |
| (4)Na2CO3 | NaHCO3 | 加热 |
| (5)Mg (OH)2 | Al(OH)3 | 加NaOH溶液、过滤 |
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,除杂时注意不能引入新杂质,且不能影响被提纯的物质,注意元素化合物知识的综合应用,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.反应3H2+N2?2NH3在密闭容器中进行.下列关于该反应的说法错误的是( )
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 将氨气液化排出能加快反应速率 | D. | N2与H2不能完全转化为NH3 |
10.对于如图装置,下列说法正确的是( )
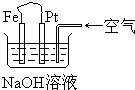

| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 | |
| C. | Pt为正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| D. | Fe为阳极,其电极反应为:Fe-2e-+2OH-═2Fe(OH)2 |
7.下列实验操作错误的是( )
| A. | 为防止试管破裂,加热固体碳酸氢钠时,试管口应略向下倾斜 | |
| B. | 为防止液体暴沸,蒸馏时可在烧瓶中加入少量碎瓷片 | |
| C. | 容量瓶可用于配制一定物质的量浓度的溶液,不可作为反应容器使用 | |
| D. | 配制500mL 0.1 mol/L NaOH溶液时,将2g NaOH固体倒入500mL容量瓶中,加水至凹液面与刻度线相切 |
11.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞呈红色的溶液:Na+、NH4+、Al3+、NO3- | |
| B. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、CO32-、ClO- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 由水电离产生的c (OH-)=1×10-14 mol•L-1溶液:K+ Na+ Cl- HCO3- |
8.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023mol-1 | |
| B. | 28g乙烯所含共用电子对数目为4×6.02×1023mol-1 | |
| C. | 1mol 苯中含有碳碳双键的数目为3×6.02×1023mol-1 | |
| D. | 2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023mol-1 |
9.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化钠溶液中通入氯气:Cl2+OH-═ClO-+Cl-+H2O | |
| B. | 铁与硫酸铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 碳酸氢钠溶液中滴入氢氧化钠溶液:OH-+HCO${\;}_{3}^{-}$═H2O+CO2↑ |
 .请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH
.请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH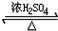 CH3COOCH2CH2CH3+H2O
CH3COOCH2CH2CH3+H2O