题目内容
20.实验室欲用NaOH固体配制1.00mol/L的NaOH溶液250mL,在配制过程中其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是( )| A. | 没有洗涤烧杯和玻璃棒 | |
| B. | 转移溶液时不慎有少量洒到容量瓶外面 | |
| C. | 容量瓶不干燥,含有少量蒸馏水 | |
| D. | 定容时俯视刻度线 |
分析 分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使溶质的物质的量n偏大或者使溶液体积V偏小的操作,溶液浓度都偏高,反正溶液浓度偏低.
解答 解:A.没有洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.转移溶液时不慎有少量洒到容量瓶外面,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故C不选;
D.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故D选;
故选:D.
点评 本题考查了一定物质的量浓度溶液配制的误差分析,准确把握操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析是解题关键,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
10.对于如图装置,下列说法正确的是( )
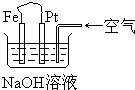

| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 | |
| C. | Pt为正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| D. | Fe为阳极,其电极反应为:Fe-2e-+2OH-═2Fe(OH)2 |
11.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞呈红色的溶液:Na+、NH4+、Al3+、NO3- | |
| B. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、CO32-、ClO- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 由水电离产生的c (OH-)=1×10-14 mol•L-1溶液:K+ Na+ Cl- HCO3- |
8.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023mol-1 | |
| B. | 28g乙烯所含共用电子对数目为4×6.02×1023mol-1 | |
| C. | 1mol 苯中含有碳碳双键的数目为3×6.02×1023mol-1 | |
| D. | 2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023mol-1 |
9.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化钠溶液中通入氯气:Cl2+OH-═ClO-+Cl-+H2O | |
| B. | 铁与硫酸铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 碳酸氢钠溶液中滴入氢氧化钠溶液:OH-+HCO${\;}_{3}^{-}$═H2O+CO2↑ |
10.下列事实不能用勒夏特列原理解释的是( )
| A. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| B. | 在沸腾的蒸馏水中滴加饱和FeCl3溶液,制Fe(OH)3胶体 | |
| C. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| D. | 用排饱和食盐水的方法收集氯气 |
