题目内容
14.在图所示的物质转化关系中,A是用于制造汽车发动机的耐高温陶瓷材料,A由两种元素组成,且两种元素化合价的绝对值相等.常温下,C、F、M是无色无味的气体单质,D、H是固体单质.E是常见的两性氧化物,L是常见的液体.B、G是汽车尾气中的主要污染气体,所含元素均为第2周期元素.反应②常用于汽车尾气的处理.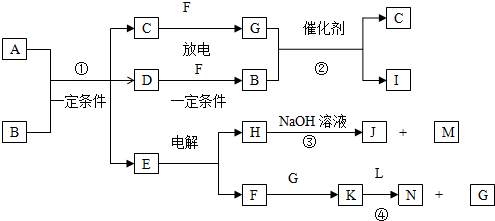
请回答下列问题:
(1)I的电子式为

(2)A的化学式为AlN
(3)写出③的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑
(4)写出反应④的化学方程式3NO2+H2O=2HNO3+NO.
分析 常温下,C、F、M是无色无味的气体单质,三者分别为H2、N2、O2中的一种,E是常见的两性氧化物,电解得到H与F,可推知E为Al2O3、H为Al、F为O2.Al与NaOH反应反应得到J与M,则J为NaAlO2、M为H2,故C为N2,C与F在放电条件下得到G为NO,B、G是汽车尾气中的主要污染气体,所含元素均为第二周期元素,反应②常用于汽车尾气的处理,气体B具有还原性,可推知B为CO,I为CO2,D是固体单质,与F(氧气)反应得到B,则D为碳单质,A是用于制造汽车发动机的耐高温陶瓷材料,A由两种元素组成,且两种元素化合价的绝对值相等,由反应①,根据元素守恒可知A为AlN,L是常见的液体,应为H2O,由转化关系可知N为HNO3,以此解答该题.
解答 解:常温下,C、F、M是无色无味的气体单质,三者分别为H2、N2、O2中的一种,E是常见的两性氧化物,电解得到H与F,可推知E为Al2O3、H为Al、F为O2.Al与NaOH反应反应得到J与M,则J为NaAlO2、M为H2,故C为N2,C与F在放电条件下得到G为NO,B、G是汽车尾气中的主要污染气体,所含元素均为第二周期元素,反应②常用于汽车尾气的处理,气体B具有还原性,可推知B为CO,I为CO2,D是固体单质,与F(氧气)反应得到B,则D为碳单质,A是用于制造汽车发动机的耐高温陶瓷材料,A由两种元素组成,且两种元素化合价的绝对值相等,由反应①,根据元素守恒可知A为AlN,L是常见的液体,应为H2O,由转化关系可知N为HNO3,
(1)I为CO2,电子式为 ,故答案为:
,故答案为: ;
;
(2)由上述分析可知,A的化学式为:AlN,故答案为:AlN;
(3)③为铝于氢氧化钠反应,反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(4)反应④为二氧化氮和水的反应,方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO.
点评 本题考查无机物推断,为高考常见题型,侧重于学生的分析能力的考查,物质的状态及转化关系中特殊反应是推断突破口,结合转化关系进行推断,对学生的逻辑推理有一定的要求,难度中等.

| A. | 氢氧化钠溶液中通入氯气:Cl2+OH-═ClO-+Cl-+H2O | |
| B. | 铁与硫酸铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 碳酸氢钠溶液中滴入氢氧化钠溶液:OH-+HCO${\;}_{3}^{-}$═H2O+CO2↑ |
| A. | 由H 2(g)、I 2(g)、HI(g)组成的混合气体平衡体系加压后颜色加深 | |
| B. | 久置的氯水变成了稀盐酸 | |
| C. | 在FeCl 3溶液中加入铁粉防止氧化变质 | |
| D. | 加入催化剂有利于SO 2与O 2反应制SO 3 |
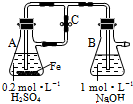
| A. | 用图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
