题目内容
14.有反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,200℃时该反应的平衡常数K=$\frac{1}{2.25}$.200℃时,将一定量的CO(g)和H2O(g)充入容积为某10L 密闭容器发生上述反应,5min 时达平衡,5min~10min只改变了一个条件,10min 时再次达平衡,各物质浓度(mol/L)变化如下:下列说法正确的是( )| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
| A. | 0~5min 时用H2O(g)表示的平均反应速率为1.2×10-3 mol/( L.min) | |
| B. | 5min~10min 改变的条件是再加入了0.1mol H2O(g) | |
| C. | 200℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.01molCO2(g)、0.01molH2(g),达平衡时,CO(g)为1.2×10-3mol/L | |
| D. | 300℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.02molCO2(g)、0.02molH2(g),则开始反应时ν(正)<ν(逆) |
分析 200℃时,将一定量的CO(g)和H2O(g)充入容积为某10L 密闭容器发生上述反应,5min 时达平衡,此时消耗一氧化碳物质的量为x,反应前后气体物质的量相同,平衡常数可以利用物质的量计算,
CO(g)+H2O(g)═CO2(g)+H2(g)△H<0
起始量(mol) 0.01 0.01 0 0
变化量(mol) x x x x
平衡量(mol) 0.01-x 0.01-x x x
$\frac{{x}^{2}}{(0.01-x)^{2}}$=$\frac{1}{2.25}$
x=0.004mol,
A.反应速率v(O2)=$\frac{△c}{△t}$;
B.5min~10min,
CO(g)+H2O(g)═CO2(g)+H2(g)△H<0
起始量(mol) 0.01 0.01 0 0
变化量(mol) 0.004 0.004 0.004 0.004
5min平衡量(mol) 0.006 0.006 0.004 0.004
10min平衡量(mol) 0.0056 0.0156 0.0044 0.0044
变化量(mol) 0.0004 0.0004 0.0004 0.0004
改变的条件是再加入了0.01mol H2O(g);
C.200℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.01molCO2(g)、0.01molH2(g),Qc=$\frac{0.01×0.01}{0.01×0.01}$=1>$\frac{1}{2.25}$,平衡逆向进行,设消耗二氧化碳为y,
CO(g)+H2O(g)═CO2(g)+H2(g)△H<0
起始量(mol) 0.01 0.01 0.01 0.01
变化量(mol) y y y y
平衡量(mol) 0.01+y 0.01+y 0.01-y 0.01-y
$\frac{(0.01-y)^{2}}{(0.01+y)^{2}}$=$\frac{1}{2.25}$
y=0.0025mol;
D.反应为放热反应,升温平衡逆向进行,平衡常数减小,300℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.02molCO2(g)、0.02molH2(g),计算此时浓度商Qc=$\frac{0.0{2}^{2}}{0.0{1}^{2}}$=4>K.
解答 解:200℃时,将一定量的CO(g)和H2O(g)充入容积为某10L 密闭容器发生上述反应,5min 时达平衡,此时消耗一氧化碳物质的量为x,反应前后气体物质的量相同,平衡常数可以利用物质的量计算,
CO(g)+H2O(g)═CO2(g)+H2(g)△H<0
起始量(mol) 0.01 0.01 0 0
变化量(mol) x x x x
平衡量(mol) 0.01-x 0.01-x x x
$\frac{{x}^{2}}{(0.01-x)^{2}}$=$\frac{1}{2.25}$
x=0.004mol,
A.反应速率v(H2O)=$\frac{△c}{△t}$=$\frac{\frac{0.004mol}{10L}}{5min}$=8×10-5mol/L,故A错误;
B.5min~10min,
CO(g)+H2O(g)═CO2(g)+H2(g)△H<0
起始量(mol) 0.01 0.01 0 0
变化量(mol) 0.004 0.004 0.004 0.004
5min平衡量(mol) 0.006 0.006 0.004 0.004
10min平衡量(mol) 0.0056 0.0156 0.0044 0.0044
变化量(mol) 0.0004 0.0004 0.0004 0.0004
5min~10min 改变的条件是再加入了0.01mol H2O(g),故B错误;
C.200℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.01molCO2(g)、0.01molH2(g),Qc=$\frac{0.01×0.01}{0.01×0.01}$=1>$\frac{1}{2.25}$,平衡逆向进行,设消耗二氧化碳为y,
CO(g)+H2O(g)═CO2(g)+H2(g)△H<0
起始量(mol) 0.01 0.01 0.01 0.01
变化量(mol) y y y y
平衡量(mol) 0.01+y 0.01+y 0.01-y 0.01-y
$\frac{(0.01-y)^{2}}{(0.01+y)^{2}}$=$\frac{1}{2.25}$,
y=0.0025mol,达平衡时,CO(g)=$\frac{0.01mol+0.0025mol}{10L}$=1.25×10-3mol/L,故C错误;
D.反应为放热反应,升温平衡逆向进行,平衡常数减小,300℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.02molCO2(g)、0.02molH2(g),计算此时浓度商Qc=$\frac{0.0{2}^{2}}{0.0{1}^{2}}$=4>K,平衡逆向进行,则开始反应时ν(正)<ν(逆),故D正确;
故选D.
点评 本题考查了化学反应速率、化学平衡、平衡常数的计算分析,影响化学平衡和平衡常数的因素理解应用,掌握基础是解题关键,题目难度中等.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案| A. | 石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应 H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
(1)煤制天然气时会发生多个反应,生产过程中有多种途径生成CH4.
已知:C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-203kJ•mol-1
写出CO与H2O(g)反应生成H2和CO2的热化学方程式CO(g)+H2O(g)=H2(g)+CO2(g),△H=-41kJ/mol.
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,
已知T℃,k(NH3•H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是ac.
a.[NH4+]>[HS-]>[OH-]>[H+]b.[HS-]>[NH4+]>[S2-]>[H+]
c.[NH4+]>[HS-]>[H2S]>[H+]d.[HS-]>[S2-]>[H+]>[OH-]
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)═CO(g)+3H2(g).
①该反应的逆反应速率表达式为:v=kc(CO)c3(H2),k为速率常数,在某温度下,测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
②在体积为2L的密闭容器中通入物质的量均为2mol的CH4和水蒸气,在一定条件下发生反应,测得H2的体积分数与温度及压强的关系如图2所示,则压强P1大于P2(填“大于”或“小于”);温度T3小于T4(填“大于”或“小于”);
③压强为P1时,在N点:v正大于v逆(填“大于”、“小于”或“等于”). 求N点对应温度下该反应的平衡常数K=48.
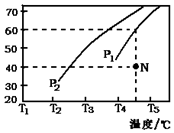
 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 |
| 温度 | T1 | T2 | T2 |
| A. | 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1 | |
| B. | T1<T2,△H>0 | |
| C. | 平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) | |
| D. | T1℃时,若起始时间向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<c(逆) |
| A. | 天然气 | B. | 油田气 | C. | 水煤气 | D. | 沼气 |
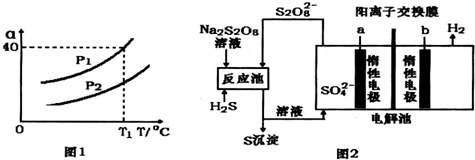
 (1)同一物质存在气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下,一个反应生成物气体的体积等于反应物气体的体积就可粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化学物的部分性质.所查资料如下:
(1)同一物质存在气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下,一个反应生成物气体的体积等于反应物气体的体积就可粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化学物的部分性质.所查资料如下: