题目内容
15.一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示.即:AmBn(s)?m An+(aq)+n Bm-(aq) c(An+)mc( Bm-)n=Ksp
已知:某温度时,Ksp(AgCl)═1.8×10-10
Ksp(Ag2CrO4)═1.1×10-12
则此温度下,在0.010mo1•L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度为1.8×10-8mol/L、1.1×10-8mol/L.
分析 在0.010mo1•L-1的AgNO3溶液中c(Ag+)=0.010mo1•L-1,形成AgCl饱和溶液时Cl-浓度:c(Cl-)=$\frac{{K}_{sp}(AgCl)}{c(A{g}^{+})}$=$\frac{1.8×1{0}^{-10}}{0.01}$mol/L=1.8×10-8mol/L,则c(AgCl)=c(Cl-),
形成Ag2CrO4饱和溶液时CrO42-的浓度:c(CrO42-)=$\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$=$\frac{1.1×1{0}^{-12}}{0.0{1}^{2}}$mol/L=1.1×10-8mol/L,则c(Ag2CrO4)=c(CrO42-).
解答 解:在0.010mo1•L-1的AgNO3溶液中c(Ag+)=0.010mo1•L-1,形成AgCl饱和溶液时Cl-浓度:c(Cl-)=$\frac{{K}_{sp}(AgCl)}{c(A{g}^{+})}$=$\frac{1.8×1{0}^{-10}}{0.01}$mol/L=1.8×10-8mol/L,则c(AgCl)=1.8×10-8mol/L,
形成Ag2CrO4饱和溶液时CrO42-的浓度:c(CrO42-)=$\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$=$\frac{1.1×1{0}^{-12}}{0.0{1}^{2}}$mol/L=1.1×10-8mol/L,则c(Ag2CrO4)=1.1×10-8mol/L,
故答案为:1.8×10-8mol/L、1.1×10-8mol/L.
点评 本题考查难溶物计算,为高频考点,侧重考查学生分析计算能力,明确溶度积常数计算方法是解本题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 |
| 温度 | T1 | T2 | T2 |
| A. | 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1 | |
| B. | T1<T2,△H>0 | |
| C. | 平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) | |
| D. | T1℃时,若起始时间向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<c(逆) |
| A. | 天然气 | B. | 油田气 | C. | 水煤气 | D. | 沼气 |
| A. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| B. | 为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触 | |
| C. | 常温下,将稀CH3COONa溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| D. | 在盛有Ca(OH)2悬浊液的绝热密闭容器中,加入少量的CaO粉末后,溶液中Ca2+数目不变,pH降低 |
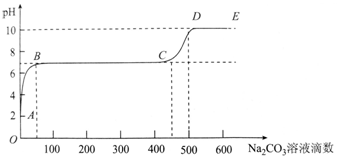
| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
①分离花生油和水
②分离乙二醇和丙三醇.已知乙二醇(C2H6O2)是无色液体,易溶于水和乙醇,沸点198℃.丙三醇(C3H8O3)是无色液体,易溶于水和乙醇,沸点290℃
③用食用酒精浸泡中草药提取其中的有效成份.
正确方法依次是( )
| A. | 分液、蒸馏、分液 | B. | 分液、蒸馏、萃取 | C. | 蒸馏、蒸馏、萃取 | D. | 蒸馏、分液、萃取 |
| A. | 冰毒、黄连素 | B. | 海洛因、麻黄碱 | C. | 大麻、摇头丸 | D. | 黄曲霉素、尼古丁 |