题目内容
20.下列电离方程式错误的是( )| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═H++Na++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | NaHCO3═H++Na++CO32- |
分析 A.氢氧化钡为强电解质,在溶液中完全电离;
B.硫酸氢钠为强电解质,在溶液中完全电离出钠离子、氢离子和硫酸根离子;
C.氯化镁在溶液中完全电离出镁离子和氯离子;
D.碳酸氢钠电离出钠离子和碳酸氢根离子,碳酸氢根离子不能拆开.
解答 解:A.氢氧化钡在溶液中完全电离出钡离子和氢氧根离子,其电离方程式为:Ba(OH)2═Ba2++2OH-,故A正确;
B.NaHSO4在溶液中完全电离,其电离方程式为:NaHSO4═H++Na++SO42-,故B正确;
C.在溶液中完全电离,MgCl2其电离方程式为:MgCl2═Mg2++2Cl-,故C正确;
D.碳酸氢钠完全电离出钠离子和碳酸氢根离子,其正确的电离方程式为:NaHCO3═Na++HCO3-,故D错误;
故选D.
点评 本题考查了电离方程式的判断,题目难度不大,正确判断强弱电解质为解答关键,注意掌握电离方程式的书写原则,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
11.下列化学反应中,离子方程式表示正确的是( )
| A. | 石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应 H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
8.下列说法中正确的是( )
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积约为22.4L | |
| C. | lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况 | |
| D. | 标准状况下,2molH2O体积约为44.8L |
15.以X原子为中心与两个氯原子及两个碘原子相结合,形成XCl2I2分子,则以下推理中正确的是( )
| A. | 如果XCl2I2分子呈正方形结构,则没有同分异构体 | |
| B. | 如果XCl2I2分子呈正方形结构,则不可能为极性分子 | |
| C. | 如果XCl2I2分子呈四面体结构,则为极性分子 | |
| D. | 如果XCl2I2分子呈四面体结构,则有2种手性异构体 |
3.下列气体主要成分不是甲烷的是( )
| A. | 天然气 | B. | 油田气 | C. | 水煤气 | D. | 沼气 |
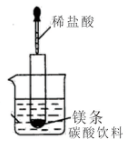 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.