题目内容
2.在下列反应中,水既不作氧化剂,又不作还原剂的是( )| A. | 2Na+2H2O=2NaOH+H2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | H2O $\frac{\underline{\;通电\;}}{\;}$ H2↑+O2↑ | D. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 |
分析 根据有元素化合价变化的反应为氧化还原反应,水中H、O元素的化合价均不变,则水在氧化还原反应中既不作氧化剂又不作还原剂.
解答 解:A.H元素化合价降低,水为氧化剂,故A错误;
B.Na2O+H2O=2NaOH的反应是非氧化还原反应,水中H、O元素的化合价均不变,则水在反应中既不作氧化剂又不作还原剂,故B正确;
C.H2O $\frac{\underline{\;通电\;}}{\;}$ H2↑+O2↑的氧化还原反应中,水既是氧化剂也是还原剂,故C错误;
D.C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2反应中H元素化合价降低,水为氧化剂,故D错误;
故选B.
点评 本题考查氧化还原反应,明确元素的化合价是解答本题的关键,并熟悉氧化还原反应中的概念来解答,难度不大.

练习册系列答案
相关题目
12.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图变化规律(图中P表示压强,T表示温度,n表示物质的量):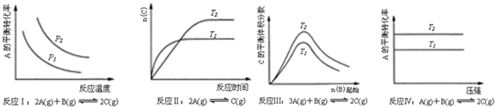
根据以上规律判断,下列结论正确的是( )

根据以上规律判断,下列结论正确的是( )
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
13.下列说法正确的是( )
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 1molH2所占的体积一定是22.4L | |
| C. | 在标准状况下,NA个任何分子所占的体积约为22.4L | |
| D. | 在标准状况下,质量为28g的CO气体,其体积约为22.4L |
17.对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在其他条件不变的情况下( )
| A. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| B. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| C. | 若在原电池中进行,反应放出的热量不变 | |
| D. | 升高温度,反应速率加快,反应放出的热量不变 |
14.下列说法正确的是( )
| A. | 2,2-二甲基-1-丁醇与2-甲基-2-丁醇互为同分异构体 | |
| B. |  的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 | |
| C. | 根据核磁共振氢谱能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 用KMnO4酸性溶液能鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO |
11.下列化学反应中,离子方程式表示正确的是( )
| A. | 石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应 H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |