题目内容
18.某实验小组利用如图装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式.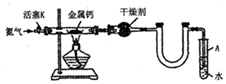
(1)按图连接好实验装置,检查装置的气密性,方法是关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热.冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好.
(2)反应过程中末端导管必须始终插入试管A的水中,目的是防止反应过程中空气进入反应管.
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应; ③反应结束后,防止反应过程中空气进入反应管;④拆除装置,取出产物.
(4)上述步骤①中通入N2-段时间后再点燃酒精灯原因是氮气排尽装置中的空气,可以防止钙与装置中的氧气或二氧化碳、水等反应,装置中干燥管后的U形管的作用是防倒吸.
(5)数据记录如表:
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2.若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以 $\frac{n(Ca)}{n(N)}$<$\frac{3}{2}$,即x<3.
分析 (1)根据检查装置的气密性的常用方法;
(2)要保证整个装置不能混入其他气体;
(3)一定要使玻璃管冷却后再停止通入气流;
(4)钙是活泼金属,能与空气中的水、二氧化碳等反应,装置中干燥管后的U形管可防倒吸,据此答题;
(5)要确定X值必须求出钙和氮的原子个数比,根据题目给的数据可做如下计算
①m(Ca)=(15.08-14.80)g=0.28g,m(N)=(15.15-15.08)g=0.07g,则n(Ca):n(N)=$\frac{0.28}{40}$:$\frac{0.07}{14}$=7:5,据此计算x;
②若通入的N2中混有少量O2,则产物中就有可能混有了CaO,而Ca3N2中钙的质量分数为81.08%,CaO中钙的质量分数为71.43%,所以产物中混有了CaO会导致钙的质量分数减小,x的值偏小.
解答 解:(1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热.冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好,
故答案为:关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热.冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好;
(2)防止反应过程中空气进入反应管,故答案为:防止反应过程中空气进入反应管;
(3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K,故答案为:熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K;
(4)钙是活泼金属,能与空气中的水、二氧化碳等反应,所以在通入N2-段时间后再点燃酒精灯,用氮气排尽装置中的空气,可以防止钙与装置中的氧气或二氧化碳、水等反应,装置中干燥管后的U形管可防倒吸,
故答案为:氮气排尽装置中的空气,可以防止钙与装置中的氧气或二氧化碳、水等反应;防倒吸;
(5)①m(Ca)=(15.08-14.80)g=0.28g,m(N)=(15.15-15.08)g=0.07g,则n(Ca):n(N)=$\frac{0.28}{40}$:$\frac{0.07}{14}$=7:5,则x=$\frac{14}{5}$,
故答案为:$\frac{14}{5}$;
②O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2.若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以 $\frac{n(Ca)}{n(N)}$<$\frac{3}{2}$,即x<3,
故答案为:O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2.若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以 $\frac{n(Ca)}{n(N)}$<$\frac{3}{2}$,即x<3.
点评 本题主要考查学生化学实验基本操作技能和处理问题的能力,以及对实验结果进行计算和误差分析判断的能力.

| A. | 平衡时c(NH3)=5mol/L | |
| B. | 平衡时HI分解率为20% | |
| C. | 混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 | |
| D. | 平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变 |
| A. | 用物质A表示2 s内的平均反应速率为0.3 mol/(L•s) | |
| B. | 用物质B表示2s内的平均反应速率为0.6 mol/(L•s) | |
| C. | 2 s后物质B的浓度为0.35 mol/L | |
| D. | 2 s后物质A的转化率为30% |
| A. | 干燥的氯气可以贮存在钢瓶中 | |
| B. | 氯气是一种黄绿色的,强烈刺激性气味的有毒气体 | |
| C. | 工业上常用电解熔融氯化钠的方法制备氯气 | |
| D. | 氯气能给水进行消毒是因为氯气与水反应生成了HClO |
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
| A. | 标准状况下,22.4 L水中含有6.02×1023个水分子 | |
| B. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| C. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L | |
| D. | 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L |

 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.