题目内容
10. 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.Y型管中一侧放镁,一侧放稀硫酸,倾斜Y型管,将稀硫酸全部倒入另一侧,反应开始.
(1)在Y型管中添加试剂时,要确保稀硫酸过量.
(2)反应前后都要调整量气管和水准管液面相平,从而保证装置内外压强相等.若读数时,量气管中的液面低于水准管的液面,实验测得H2的体积将偏小.(填“偏大”“偏小”或“不变”)
(3)若镁的质量为mg,cmol/L硫酸溶液VmL,反应后收集到的氢气体积为amL(已折算为标准状况下),则镁的相对原子质量为$\frac{22400m}{a}$.
分析 根据实验原理即测定一定质量的镁与足量的稀硫酸反应生成的氢气体积,根据氢气的量计算镁的物质的量,最后再根据M=$\frac{m}{n}$计算镁的相对原子质量,测量氢气体积时注意量气管的使用方法,据此分析解答.
解答 解:(1)根据实验原理镁与足量的稀硫酸反应,所以在Y型管中添加试剂时,要确保稀硫酸过量,故答案为:稀硫酸;
(2)反应前后应调整量气管和水准管液面相平,保持装置内外压强;若读数时,量气管中的液面低于水准管的液面,说明内部气压大于大气压,则量气管中气体的体积将偏小,故答案为:装置内外压强;偏小;
(3)根据镁与硫酸反应的方程式Mg+H2SO4=MgSO4+H2↑,则镁的物质的量为$\frac{a×10{\;}^{-3}L}{22.4L/mol}$,所以镁的相对原子质量M=$\frac{m}{n}$=$\frac{m}{\frac{a×10{\;}^{-3}}{22.4}}$=$\frac{22400m}{a}$,故答案为:$\frac{22400m}{a}$.
点评 本题考查了测定镁的相对原子质量的分析判断,量气管的使用方法是难点,题目难度中等.

练习册系列答案
相关题目
18.某实验小组利用如图装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式.
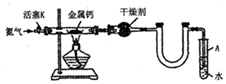
(1)按图连接好实验装置,检查装置的气密性,方法是关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热.冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好.
(2)反应过程中末端导管必须始终插入试管A的水中,目的是防止反应过程中空气进入反应管.
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应; ③反应结束后,防止反应过程中空气进入反应管;④拆除装置,取出产物.
(4)上述步骤①中通入N2-段时间后再点燃酒精灯原因是氮气排尽装置中的空气,可以防止钙与装置中的氧气或二氧化碳、水等反应,装置中干燥管后的U形管的作用是防倒吸.
(5)数据记录如表:
①计算得到实验式CaxN2,其中x=$\frac{14}{5}$.
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2.若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以 $\frac{n(Ca)}{n(N)}$<$\frac{3}{2}$,即x<3.

(1)按图连接好实验装置,检查装置的气密性,方法是关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热.冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好.
(2)反应过程中末端导管必须始终插入试管A的水中,目的是防止反应过程中空气进入反应管.
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应; ③反应结束后,防止反应过程中空气进入反应管;④拆除装置,取出产物.
(4)上述步骤①中通入N2-段时间后再点燃酒精灯原因是氮气排尽装置中的空气,可以防止钙与装置中的氧气或二氧化碳、水等反应,装置中干燥管后的U形管的作用是防倒吸.
(5)数据记录如表:
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2.若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以 $\frac{n(Ca)}{n(N)}$<$\frac{3}{2}$,即x<3.
19.已知2SO2(g)+O2(g)?2SO3(g)△H=-198.0 kJ•mol-1.若在500℃和催化剂的作用下,反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
| A. | 该反应条件下,初始时向容器中充入2molSO2和1molO2,反应平衡时,可以释放198.0 kJ的热量 | |
| B. | 达到平衡时,SO2和SO3的浓度一定相等 | |
| C. | 反应体系中,当混合物的密度保持不变,反应达到平衡 | |
| D. | 增大压强和升高温度有利于加快反应速率,但升高温度对平衡转化率不利 |
15.已知:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡后,改变下列条件有利于提高SO2转化率的是( )
| A. | 加催化剂 | B. | 升高温度 | C. | 减小压强 | D. | 加入O2 |
2.已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.
它可用于制备苯甲酸乙酯和苯甲酸铜.
(一)制备苯甲酸乙酯
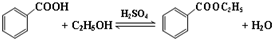
相关物质的部分物理性质如表格:
实验流程如下:

(1)制备苯甲酸乙酯,下列装置最合适的是B,带“分水器”的冷凝回流装置与一般的冷凝装置相比,主要优点在于分离出生成的水,促进酯化反应向正向进行
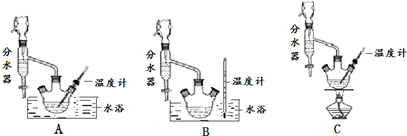
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,加入无水MgSO4.乙醚的作用是萃取出水层中溶解的苯甲酸乙酯,提高产率
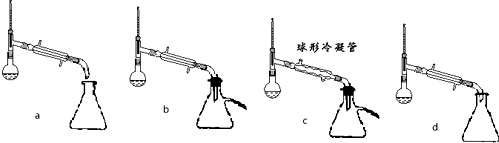
(5)步骤⑤蒸馏操作中,下列装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因为苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品.
(7)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
它可用于制备苯甲酸乙酯和苯甲酸铜.
(一)制备苯甲酸乙酯
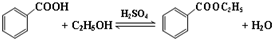
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |
实验流程如下:

(1)制备苯甲酸乙酯,下列装置最合适的是B,带“分水器”的冷凝回流装置与一般的冷凝装置相比,主要优点在于分离出生成的水,促进酯化反应向正向进行

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,加入无水MgSO4.乙醚的作用是萃取出水层中溶解的苯甲酸乙酯,提高产率
(5)步骤⑤蒸馏操作中,下列装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因为苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品.
(7)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
20.在一定条件下,下列可逆反应达到化学平衡:H2(g)+I(g)?2HI(g);△H<0,要使混合气体的紫色加深,可以采取的方法是( )
| A. | 保持体积不变加入H2 | B. | 压缩体积至原来的一半 | ||
| C. | 降低温度 | D. | 加入催化剂 |