题目内容
氯气在生产生活中应用广泛.
实验室可用MnO2与浓盐酸反应制取,反应原理如下:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2L Cl2,则被氧化的HCl为 mol.
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为 .工业上也可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域.请写出该化学反应的化学方程式 .
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的广泛可制备纯净的MnO2,其制备过程如图所示:
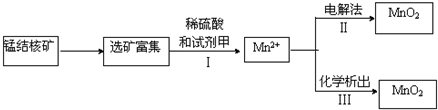
①步骤I中,试剂甲必须具有的性质是 (填序号).
a.氧化性b.还原性c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,该反应的离子方程式为 .
(4)用100mL 12.0mol?L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30mol,请你分析可能的原因为 .
实验室可用MnO2与浓盐酸反应制取,反应原理如下:
MnO2+4HCl(浓)
| ||
(1)若制得标准状况下11.2L Cl2,则被氧化的HCl为
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的广泛可制备纯净的MnO2,其制备过程如图所示:

①步骤I中,试剂甲必须具有的性质是
a.氧化性b.还原性c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,该反应的离子方程式为
(4)用100mL 12.0mol?L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30mol,请你分析可能的原因为
考点:制备实验方案的设计,氯气的化学性质,海水资源及其综合利用
专题:实验设计题,元素及其化合物
分析:(1)Cl元素化合价升高,被氧化,结合氯气的体积和方程式计算;
(2)氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠;MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,以此书写反应方程式;
(3)①步骤I中,Mn元素的化合价由+4价降低为+2价;
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,利用电子守恒确定还原产物,以此书写离子反应;
(4)稀盐酸与二氧化锰不反应.
(2)氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠;MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,以此书写反应方程式;
(3)①步骤I中,Mn元素的化合价由+4价降低为+2价;
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,利用电子守恒确定还原产物,以此书写离子反应;
(4)稀盐酸与二氧化锰不反应.
解答:
解:(1)n(Cl2)=
=0.5mol,由方程式可知被氧化的HCl的物质的量为1mol,故答案为:1;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH?=Cl-+ClO-+H2O,
业上可用MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,该反应为2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl,
故答案为:Cl2+2OH?=Cl-+ClO-+H2O;2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl;
(3)①步骤I中,Mn元素的化合价由+4价降低为+2价,则试剂甲应具有还原性,故答案为:b;
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,设还原产物中Cl的化合价为x,
则由电子守恒可知,0.05mol×(4-2)=0.1mol/L×0.2L×(5-x),解得x=0,即生成氯气,则离子反应为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+,
故答案为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(4)用100mL12.0mol?L-1的浓盐酸与足量MnO2混合后,加热,随着反应的进行,盐酸的浓度逐渐降低,还原性逐渐减弱,则生成的氯气的物质的量小于0.30mol,
故答案为:随着反应的进行,盐酸浓度减小,反应终止.
| 11.2L |
| 22.4L/mol |
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH?=Cl-+ClO-+H2O,
业上可用MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,该反应为2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl,
故答案为:Cl2+2OH?=Cl-+ClO-+H2O;2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl;
(3)①步骤I中,Mn元素的化合价由+4价降低为+2价,则试剂甲应具有还原性,故答案为:b;
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,设还原产物中Cl的化合价为x,
则由电子守恒可知,0.05mol×(4-2)=0.1mol/L×0.2L×(5-x),解得x=0,即生成氯气,则离子反应为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+,
故答案为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(4)用100mL12.0mol?L-1的浓盐酸与足量MnO2混合后,加热,随着反应的进行,盐酸的浓度逐渐降低,还原性逐渐减弱,则生成的氯气的物质的量小于0.30mol,
故答案为:随着反应的进行,盐酸浓度减小,反应终止.
点评:本题以氯气及其化合物的性质考查氧化还原反应,明确信息及流流程中Mn元素的化合价变化、电子守恒即可解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注.235 92U是一种重要的核燃料,
U和
U的关系是( )
235 92 |
238 92 |
| A、中子数相同 |
| B、同种原子 |
| C、同位素 |
| D、同种核素 高温 |
下列离子方程式正确的是( )
| A、澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | ||||
| B、钠与水的反应Na+2H2O═Na++2OH-+H2↑ | ||||
| C、硫酸氢钠溶液与少量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | ||||
D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
|
在强酸性溶液中能大量共存的无色透明离子组是( )
| A、K+、Na+、NO3-、HCO3- |
| B、K+、Na+、Cl-、SO42- |
| C、K+、Na+、Cl-、Cu2+ |
| D、Mg2+、Ba2+、NO3-、SO42- |