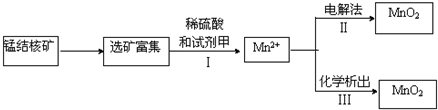
题目内容
铜片放入在浓硝酸中:
(1)开始时反应的化学方程式为: ,实验现象为 .
(2)若铜有剩余,则反应将要结束时的化学方程式为: .
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是 .
(1)开始时反应的化学方程式为:
(2)若铜有剩余,则反应将要结束时的化学方程式为:
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是
考点:硝酸的化学性质
专题:氮族元素
分析:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,二氧化氮是红棕色气体,铁盐溶液呈黄色;
(2)铜有剩余,铜和稀硝酸反应生成硝酸铜和NO;
(3)酸性条件下,硝酸根离子具有强氧化性,又继续和铜反应.
(2)铜有剩余,铜和稀硝酸反应生成硝酸铜和NO;
(3)酸性条件下,硝酸根离子具有强氧化性,又继续和铜反应.
解答:
解:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,二氧化氮是红棕色气体,铁盐溶液呈黄色,所以看到的现象是:溶液逐渐变黄色,有红棕色气体逸出,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
溶液逐渐变黄色,有红棕色气体逸出;
(2)铜有剩余,随着反应的进行,硝酸浓度逐渐减小,当变为稀硝酸时,铜和稀硝酸反应生成硝酸铜和NO,反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)加入稀硫酸后,氢离子原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应,发生的反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为:加入稀硫酸后,氢离子与原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应.
溶液逐渐变黄色,有红棕色气体逸出;
(2)铜有剩余,随着反应的进行,硝酸浓度逐渐减小,当变为稀硝酸时,铜和稀硝酸反应生成硝酸铜和NO,反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)加入稀硫酸后,氢离子原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应,发生的反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为:加入稀硫酸后,氢离子与原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应.
点评:本题考查了硝酸的性质,硝酸的浓度不同导致其氧化性不同,和铜反应时其产物不同,酸性条件下硝酸根离子具有强氧化性,题目难度不大.

练习册系列答案
相关题目
已知还原性S2->I->Fe2+>Br->Cl-,下列判断不正确的是( )
| A、Fe3+与I-在水溶液中不能大量共存 |
| B、氧化性:Cl2>Br2>I2 |
| C、将足量Br2加入到FeCl2溶液中,离子反应方程式为Br2+2Cl-═2Br-+Cl2 |
| D、将Cl2通入到FeBr2溶液中,Cl2应优先氧化Fe2+,再氧化Br- |
已知:
①2H2(g)+O2(g)→2H2O(g)+483.6kJ;
②H2(g)+S(g)→H2S(g)+20.1kJ.
下列判断一定正确的是( )
①2H2(g)+O2(g)→2H2O(g)+483.6kJ;
②H2(g)+S(g)→H2S(g)+20.1kJ.
下列判断一定正确的是( )
| A、1mol氢气完全燃烧吸热246.8 kJ |
| B、1mol水蒸气和1mol硫化氢的能量相差221.7 kJ |
| C、由①②知,水的热稳定性小于硫化氢 |
| D、若反应②中改用固态硫,放热将小于20.1 kJ |
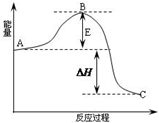 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题: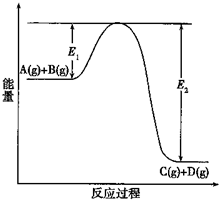 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.