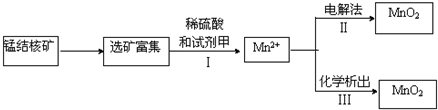
题目内容
为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验.
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L.样品中铝的质量是 g.
(2)若取a g样品将其点燃,恰好完全反应,反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b= .
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L.样品中铝的质量是
(2)若取a g样品将其点燃,恰好完全反应,反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b=
考点:有关混合物反应的计算
专题:计算题
分析:(1)发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据n=
计算氢气的物质的量,利用方程式计算铝的物质的量,再根据m=nM计算Al的质量;
(2)发生反应:2Al+Fe2O3
Al2O3+2Fe,由方程式可知,生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,注意铁与盐酸反应生成氯化亚铁.
| V |
| Vm |
(2)发生反应:2Al+Fe2O3
| ||
解答:
解:标准状况下bL氢气的物质的量为
=
mol,由方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,样品中铝的物质的量为
mol×
=
mol,故Al的质量=
mol×27g/mol=
g,
故答案为:
;
(2)由方程式2Al+Fe2O3
2Fe+Al2O3可知,生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(2)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,
故答案为:2:3.
| bL |
| 22.4L/mol |
| b |
| 22.4 |
| b |
| 22.4 |
| 2 |
| 3 |
| b |
| 33.6 |
| b |
| 33.6 |
| 9b |
| 11.2 |
故答案为:
| 9b |
| 11.2 |
(2)由方程式2Al+Fe2O3
| ||
故答案为:2:3.
点评:本题考查混合物计算、根据方程式的计算等,难度不大,(2)利用电子转移守恒计算,简化计算步骤,注意基础知识的掌握.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A、K+、H+、I-、MnO4- |
| B、Fe3+、Fe2+、SO42-、NO3- |
| C、Al3+、Na+、SO42-、CO32- |
| D、Fe3+、H+、SO42-、ClO- |
下列叙述正确的是( )
| A、含最高价元素的化合物,一定具有强氧化性 |
| B、阳离子只有氧化性,阴离子只有还原性 |
| C、失电子多的还原剂,还原性强 |
| D、得电子能力强的物质,氧化性强 |
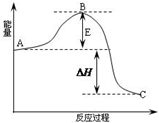 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题: